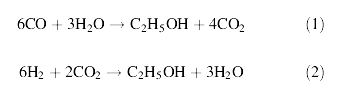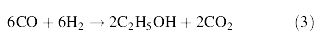บทนำ
ปัจจุบันมนุษย์มีความต้องการใช้พลังงานเพิ่มมากขึ้น โดยนำไปใช้ในกิจกรรมเพื่อพัฒนาและสร้างความเจริญเติบโตทางเศรษฐกิจของประเทศต่างๆในโลก พลังงานส่วนใหญ่ที่ใช้ในปัจจุบันเป็นพลังงานที่ได้มาจากเชื้อเพลิงฟอสซิล เช่น น้ำมัน ก๊าซธรรรมชาติและถ่านหิน เป็นที่ทราบกันว่าเชื้อเพลิงฟอสซิลไม่สามารถผลิตขึ้นมาทดแทนได้ทันกับความต้องการในการใช้พลังงานที่มีมากขึ้น ทำให้การใช้เชื้อเพลิงฟอสซิลมีไม่เพียงพอ ดังนั้นจึงมีความจำเป็นต้องมองหาพลังงานทางเลือก (Alternative energy) ชนิดใหม่มาทดแทนพลังงานจากเชื้อเพลิงฟอสซิลที่มีอยู่เดิม พลังงานทางเลือกที่สามารถนำมาใช้ทดแทนเชื้อเพลิงฟอสซิลได้มีอยู่หลายชนิดด้วยกัน เช่น พลังงานจากชีวมวล (Biomass) ซึ่งเป็นพลังงานที่ได้จากอินทรีย์สารของพืชและสัตว์ต่างๆ ได้แก่ พืชเกษตรกรรม วัสดุเหลือทิ้งทางการเกษตรและอุตสาหกรรม เศษไม้ ขยะมูลฝอย ฯลฯ โดยใช้กระบวนการ แปรรูปชีวมวลไปเป็นพลังงานรูปแบบต่างๆ ได้แก่ การเผาไหม้โดยตรง การผลิตก๊าซ การหมัก และการผลิตเชื้อเพลิงเหลวจากพืช นอกจากพลังงานจากชีวมวลแล้ว ยังมีพลังงานแสงอาทิตย์ พลังงานน้ำ พลังงานลม และพลังงานนิวเคลียร์ โดยคุณสมบัติที่สำคัญของพลังงานทางเลือกคือ เป็นพลังงานสะอาด มีการปลดปล่อยก๊าซพิษน้อยกว่าเชื้อเพลิงฟอสซิล และสามารถสร้างทดแทนได้ตลอดเวลา พลังงานจากชีวมวลจึงมีความน่าสนใจและได้รับความนิยมเป็นอย่างมาก เนื่องจากเป็นพลังงานที่มีราคาถูกเมื่อเปรียบเทียบกับการใช้น้ำมัน อีกทั้งประเทศไทยเป็นประเทศเกษตรกรรมทำให้มีผลผลิตทางการเกษตรเป็นจำนวนมาก จึงส่งผลให้ต้นทุนในการผลิตเชื้อเพลิงจากชีวมวล มีราคาไม่สูงมากนัก นอกจากนี้การใช้เชื้อเพลิงจากชีวมวลยังสามารถช่วยรักษาสภาพแวดล้อมได้ เนื่องจากการใช้พลังงานจากชีวมวลจะไม่ก่อให้เกิดก๊าซที่เป็นพิษต่อสิ่งมีชีวิตและสิ่งแวดล้อมเหมือนกับการใช้เชื้อเพลิง ฟอสซิล ก๊าซเหล่านี้ ได้แก่ ก๊าซคาร์บอนไดออกไซด์ (CO2) ไนโตรเจนไดออกไซด์ (NO2) ซึ่งมีความเป็นพิษโดยตรงต่อสิ่งมีชีวิตและทำให้เกิดปัญหาภาวะโลกร้อน (Global warming) นอกจากนี้ การใช้เชื้อเพลิงฟอสซิล ยังปลดปล่อยสารที่เป็นพิษอื่นๆ เช่น คาร์บอนมอนอกไซด์ (CO) ฝุ่นละอองขนาดเล็กและไอระเหยของสารประกอบอินทรีย์ชนิดต่างๆ ออกมา ทำให้แต่ละประเทศมีการศึกษาเกี่ยวกับพลังงานจากชีวมวลกันมากขึ้นเพื่อนำชีวมวลประเภทต่างๆ มาใช้ผลิตเป็นพลังงานทดแทนเชื้อเพลิงฟอสซิล นอกจากนี้ ภายหลังจากการแปรรูปชีวมวลเป็นพลังงานแล้วส่วนที่เหลือยังสามารถนำไปทำปุ๋ยให้กับพืชได้ เนื่องจากยังคงมีแร่ธาตุต่างๆ อย่างสมบูรณ์ เช่น แคลเซียม (Ca) แมกนีเซียม (Mg) โพแทสเซียม (K) และฟอสฟอรัส (P) ดังนั้นพลังงานจากชีวมวลจัดเป็นพลังงานสีเขียวที่มีส่วนสำคัญในการลดการปลดปล่อยก๊าซเรือนกระจกได้ เช่น CO2 และ NO2 และช่วยให้เศรษฐกิจของโลกมีความสมดุลมากยิ่งขึ้น เนื่องจากส่งผลให้ราคาพืชผลทางการเกษตรสูงขึ้นและสามารถแข่งขันกับราคาน้ำมันที่สูงขึ้นได้ทำให้ประเทศเกษตรกรรมลดการพึ่งพาเชื้อเพลิงฟอสซิลจากประเทศผู้ผลิตน้ำมันได้ การนำชีวมวลมาใช้ประโยชน์โดยไปผสมหรือใช้ร่วมกับเชื้อเพลิงฟอสซิลสามารถลดการใช้พลังงานจากเชื้อเพลิงฟอสซิล อีกทั้งยังสามารถนำไปใช้ในบ้านเรือน หรือภาคเกษตรกรรมได้ เช่น ใช้กับเครื่องยนต์ในฟาร์ม ใช้ในการปั้มน้ำ การให้แสงสว่างและให้ความร้อน นอกจากนี้ ยังนำไปใช้ในอุตสาหกรรมขนาดใหญ่เพื่อให้ความร้อนได้อีกด้วย การนำไปใช้ในอุตสาหกรรมขนาดใหญ่เป็นการพัฒนาที่ยั่งยืนให้กับหลายๆ ด้าน เช่น สิ่งแวดล้อม สังคม และเศรษฐกิจ รวมทั้งการสร้างคุณภาพชีวิตที่ดีให้กับมนุษย์และสิ่งมีชีวิตอื่นๆ บทความนี้ได้กล่าวถึงวิธีการแปรรูปชีวมวลไปเป็นพลังงาน รวมถึงความแตกต่างของพลังงานที่ได้จากการแปรรูปและการนำพลังงานจากชีวมวลไปใช้ประโยชน์
แหล่งสำคัญของพลังงานจากชีวมวล
ชีวมวล หมายถึง วัสดุที่ได้จากธรรมชาติซึ่งอาจเป็นสิ่งมีชีวิตหรือส่วนประกอบของธรรมชาติรวมทั้งสิ่งเหลือทิ้งจากสิ่งมีชีวิตที่สามารถสร้างทดแทนได้ ชีวมวลที่นำไปแปรรูปเป็นพลังงานส่วนใหญ่เป็นพืชหรือส่วนประกอบของพืช โดยพืชจะนำ CO2 ไปใช้ในกระบวนการสังเคราะห์แสงเพื่อผลิตก๊าซออกซิเจน (O2) ดังนั้นเมื่อนำชีวมวลที่ได้จากพืชมาใช้ในการแปรรูปเป็นเชื้อเพลิงโดยการนำไปเผา จึงทำให้ไม่มีการปลดปล่อยก๊าซ CO2 เพิ่มสู่ชั้นบรรยากาศ ชีวมวลที่ได้จากธรรมชาติมีอยู่หลายชนิดด้วยกัน สามารถจำแนกแหล่งที่มาของชีวมวลได้ดังนี้ (Laohalidanond, K., 2007)
1. พืชเกษตรกรรม (Agricultural crop) เช่น อ้อย มันสำปะหลัง ข้าวโพด ฯลฯ ซึ่งเป็นแหล่งสำคัญของคาร์โบไฮเดรต แป้งและน้ำตาลสามารถปลูกเป็นพืชที่ให้พลังงานและผลิตเป็นน้ำมันพืช (Vegetable oil) ได้ นอกจากนี้ยังมีพืชที่ปลูกเพื่อนำไปผลิตเป็นเชื้อเพลิงโดยเฉพาะ เช่น ปาล์มน้ำมัน และสบู่ดำ
2. วัสดุเหลือทิ้งทางการเกษตร (Agricultural residues) เช่น ฟางข้าว รากมันสำปะหลัง ซังข้าวโพด กากถั่วเหลือง
3. เนื้อไม้และเศษเหลือทิ้งของเนื้อไม้ (Wood and wood residues) เช่น ไม้โตเร็วและไม้ยืนต้นทั่วไป เศษเหลือทิ้งจากโรงงานผลิตไม้ รวมทั้งเศษเหลือทิ้งจากอุตสาหกรรมเยื่อและกระดาษ ฯลฯ
4. เศษเหลือทิ้งจากอุตสาหกรรม (Waste streams) เช่น แกลบจากโรงสีข้าว กากน้ำตาลและชานอ้อยจากอุตสาหกรรมผลิตน้ำตาล และเศษเหลือทิ้งจากการสกัดปาล์มน้ำมัน
5. ขยะมูลฝอยและมูลสัตว์ เช่น ขยะที่เป็นของสดและมูลสัตว์ต่างๆ (Choorit, W. and Wisarnwan, P., 2007)
6. สิ่งมีชีวิตบางชนิด เช่น สาหร่ายนำไปใช้ประโยชน์ได้หลายรูปแบบ ได้แก่ การย่อยสลายแบบไม่ใช้ออกซิเจน ไบโอดีเซลจากสาหร่ายและการผลิตเชื้อเพลิงไฮโดรเจน (Hossain, ABMS., et al., 2008)
ประเทศไทยมีการปลูกพืชเกษตรกรรมหลายชนิด แต่จากการสำรวจพบว่ามีพืชเกษตรกรรมอยู่ 4 ชนิดหลักที่มีปริมาณมากเพียงพอต่อการนำมาผลิตพลังงานจากชีวมวลได้คือ อ้อย ข้าว มันสำปะหลัง และปาล์มน้ำมัน ดังแสดงในตารางที่ 1
ตารางที่ 1 ปริมาณชีวมวล 4 ชนิด(หน่วยเป็นกิโลตัน) ที่มีปริมาณมากในประเทศไทยตั้งแต่ปี 2001-2006
|
|
00/01
|
01/02
|
02/03
|
03/04
|
04/05
|
05/06
|
|
อ้อย
|
49,563
|
60,013
|
74,263
|
70,101
|
67,900
|
63,621
|
|
ข้าว
|
25,844
|
26,523
|
26,057
|
26,841
|
24,977
|
26,493
|
|
มันสำปะหลัง
|
19,064
|
18,396
|
16,868
|
19,718
|
16,977
|
18,246
|
|
ปาล์มน้ำมัน
|
3,256
|
4,089
|
4,001
|
4,903
|
5,192
|
5,513
|
ที่มา : Laohalidanond, K. (2007)
เทคโนโลยีที่สำคัญในการแปรรูปชีวมวลเป็นพลังงาน
การแปรรูปชีวมวลเป็นพลังงานนั้นมีอยู่ด้วยกันหลายวิธี จำแนกได้เป็น 3 วิธีหลักคือ
1. วิธีเคมีความร้อน (Thermochemical process) เป็นการแปรรูปชีวมวลให้เป็นพลังงานโดยการใช้ความร้อนจนเกิดการเปลี่ยนแปลงทางเคมี เช่น การเผาไหม้โดยใช้ออกซิเจนหรือการสันดาป (Combustion) การเผาไหม้โดยไม่ใช้ออกซิเจนหรือไพโรลิซิส (Pyrolysis) และการทำให้เกิดก๊าซ (Gasification)
2. วิธีชีวเคมี (Biochemical process) เป็นการแปรรูปชีวมวลเป็นพลังงานโดยอาศัยปฏิกิริยาทางชีวเคมีซึ่งต้องพึ่งพาจุลชีพชนิดต่างๆ เช่น แบคทีเรียและรา โดยนำไปหมักจนเกิดการเปลี่ยนแปลงเป็นสารอินทรีย์ที่นำไปใช้เป็นพลังงานได้ในรูปของเอทานอลและก๊าซมีเทน (CH4)
3.วิธีปฏิกิริยาเคมี (Chemical process) เป็นการแปรรูปชีวมวลเป็นพลังงานโดยการใช้ปฏิกิริยาเคมี เช่น การผลิตไบโอดีเซล (Hertzmark, D., 1982) โดยลักษณะและผลิตภัณฑ์ที่ได้จากเทคโนโลยีการแปรรูปชีวมวลไปเป็นพลังงานของแต่ละวิธีมีรายละเอียดดังนี้
A. การเผาไหม้หรือการสันดาป (Combustion) (Yang, YB., et al., 2008 ; Malatak, J., et al., 2007)
การเผาไหม้หรือการสันดาป เป็นวิธีการเก่าแก่และง่ายที่สุดในการแปรรูปชีวมวลเป็นพลังงาน การเผาไหม้ส่วนใหญ่จะใช้วัตถุดิบที่เป็นไม้หรือเปลือกไม้ชนิดต่างๆ ในรูปของฟืน พลังงานที่ได้มีค่าประสิทธิภาพความร้อน (Heating value ซึ่งหมายถึง ค่าพลังงานที่ผลิตได้/ค่าพลังงานที่ให้) ประมาณ 35-40% ซึ่งถือว่าเป็นวิธีที่มีประสิทธิภาพในการแปรรูปชีวมวลเป็นพลังงานน้อยที่สุด ซึ่งต่อมาได้มีการพัฒนาวิธีในการเพิ่มประสิทธิภาพให้กับการเผาไหม้โดยการเพิ่มความดันในการเผาไหม้และการจำกัดออกซิเจนในเตาเผา
นอกจากการเผาไหม้แล้วยังมีการพัฒนาเพื่อเพิ่มประสิทธิภาพของการให้พลังงาน โดยเริ่มจากการนำ ชีวมวลชนิดต่างๆ ที่มีอยู่ในธรรมชาติ เช่น แกลบ ฟางข้าว กาบมะพร้าว ใยมะพร้าว ชานอ้อย และซังข้าวโพด รวมทั้งขี้เลื่อยมาทำให้แห้งก่อน แล้วจึงนำชีวมวลนั้นมาเผาซึ่งเป็นการให้ความร้อนโดยตรง แต่เนื่องจากชีวมวลเหล่านั้นมีความชื้นมากและมีความหนาแน่นน้อยทำให้ได้ค่าประสิทธิภาพความร้อนต่ำ จึงไม่เหมาะที่จะนำมาเผาไหม้โดยตรงและทำให้เกิดความไม่สะดวกในด้านต่างๆ เช่น การขนส่งและการจัดเก็บ ซึ่งต้องใช้พื้นที่มาก ดังนั้นจึงได้มีการนำชีวมวลมาอัดเป็นก้อนเพื่อเพิ่มความหนาแน่นและประสิทธิภาพด้านความร้อนให้สูงขึ้น โดยการนำชีวมวลไปบดแล้วอัดเป็นก้อน ผลที่ได้คือ มีประสิทธิภาพความร้อนเพิ่มขึ้น นอกจากนี้มีการพัฒนาโดยใช้ชีวมวลตั้งแต่ 2 ชนิดขึ้นไปนำมาผสมให้เข้ากันในอัตราส่วนต่างๆ แล้วใส่ตัวประสานเข้าไปเพื่อช่วยให้ชีวมวลยึดติดกันมากขึ้น เป็นการเพิ่มประสิทธิภาพความร้อนให้สูงขึ้น โดยประสิทธิภาพความร้อนที่ได้ขึ้นอยู่กับปัจจัยต่างๆ เช่น วัตถุดิบที่ใช้ ปริมาณของการผสมวัตถุดิบ ชนิดและปริมาณของตัวประสาน ขนาดของก้อนเชื้อเพลิงซึ่งการนำพลังงานที่ได้จากการเผาไหม้ไปใช้ประโยชน์มีหลายลักษณะดังนี้ (Chomcharn, A., 1982)
- สำหรับการหุงต้มอาหาร เป็นที่นิยมมากในชนบท เช่น ทำเป็นฟืน ถ่าน ไม้ และเศษเหลือทิ้งทางเกษตรกรรม
- สำหรับอุตสาหกรรมท้องถิ่น เช่น นำไปเป็นตัวให้ความร้อนในเตาเผาสำหรับการทำอิฐ เซรามิก ยาสูบ
- สำหรับอุตสาหกรรมขนาดกลาง การแปรรูปชีวมวลเป็นพลังงานโดยอาศัยการเผาไหม้ถือว่ามีประสิทธิภาพน้อยเมื่อเทียบกับวิธีอื่นที่ใช้ในปัจจุบัน กล่าวคือ ถ้าต้องการพลังงานจากการเผาไหม้มากจะต้องสิ้นเปลืองวัตถุดิบ รวมทั้งการขนส่งและพื้นที่ในการจัดเก็บมากตามไปด้วย และยังไม่สามารถจัดเก็บพลังงานที่ได้เพื่อนำไปใช้ประโยชน์หรือขนส่งพลังงานไปใช้ในที่อื่นๆ ได้ นอกจากนี้การเผาไหม้โดยตรงยังก่อให้เกิดมลภาวะต่อสิ่งแวดล้อมเนื่องจากสารเคมีในชีวมวลเหล่านั้นเมื่อได้รับความร้อนสูงขึ้นในระดับหนึ่งจะเกิดการแปรสภาพเป็นสารพิษ ก่อให้เกิดอันตรายแก่คนที่อยู่ข้างเคียง โดยเฉพาะโรคระบบทางเดินหายใจและโรคมะเร็ง นอกจากนี้ ยังไม่รวมถึงหมอกควันที่เกิดจากการเผาไหม้ที่สร้างทัศนวิสัยที่ไม่ดีให้กับผู้ที่อยู่รอบข้าง โดยมีตัวอย่างที่เกิดขึ้นในประเทศจีนที่ประสบปัญหาอยู่ในขณะนี้ (Jingjing, L., et al., 2001)
B.ไพโรลิซิส (Pyrolysis) (Bhattacharya, SC., 1982; Bridgwater, AV., 1999)
ไพโรลิซิส (Pyrolysis) หรือ การเผาโดยไม่ใช้ออกซิเจน เป็นการสลายวัตถุดิบที่มีองค์ประกอบของคาร์บอนโดยใช้อุณหภูมิสูงระหว่าง 400-800 เคลวิน โดยไม่เกิดการออกซิไดซ์ซึ่งชีวมวลที่ใช้ในกระบวนการนี้คือ พืชที่มีเซลลูโลส หรือ ไม้ยืนต้นต่างๆ เศษไม้ ฟาง ฯลฯ
วิธีในการแปรรูปชีวมวลไปเป็นพลังงานเริ่มจากการลำเลียงและการทำให้ชีวมวลแห้ง เมื่อชีวมวลแห้ง ดีแล้วจึงนำไปหั่นเป็นชิ้นเล็กๆ จากนั้นนำไปใส่ในส่วนที่ทำให้เกิดปฏิกิริยาไพโรลิซิส ผลิตภัณฑ์ที่ได้จะถูกนำไปแยกส่วนที่เป็นของแข็งและเถ้าออกจากของเหลว จากนั้นจึงนำส่วนที่เป็นของเหลวไปเก็บไว้ในถังเก็บ ซึ่งความร้อนที่ใช้ในปฏิกิริยาไพโรลิซิสเป็นความร้อนแบบทางตรงและทางอ้อม ความร้อนทางอ้อม หมายถึง การให้ความร้อนภายนอก ได้แก่ การเผาด้วยก๊าซ ส่วนความร้อนทางตรงคือ การใช้ลมร้อนจากเหล็ก ผลิตภัณฑ์ที่ได้จากปฏิกิริยาไพโรลิซิสจะเป็นของผสมระหว่างก๊าซ ของเหลวและถ่าน ซึ่งสัดส่วนของก๊าซ ของเหลวและถ่านนั้นจะขึ้นอยู่กับวิธีและรูปแบบของปฏิกิริยาไพโรลิซิส และปัจจัยต่างๆ ดังแสดงในตารางที่ 2
ตารางที่ 2 รูปแบบของปฏิกิริยาไพโรลิซิสแบบต่างๆ
|
รูปแบบของปฏิกิริยาไพโรลิซิส
|
เวลา
|
ความร้อนที่ให้
|
สภาพในการทำปฏิกิริยา
|
ความดัน
(บาร์)
|
อุณหภูมิ
(เคลวิน)
|
ผลิตภัณฑ์
|
|
การทำถ่าน
|
ชม./วัน
|
ต่ำมาก
|
สิ่งที่ได้จาก
การเผาไหม้
|
1
|
400
|
ของแข็ง
|
|
แบบเดิม
|
5-30 นาที
|
ต่ำ
|
สิ่งที่ได้จากผลิตภัณฑ์ปฐมภูมิและทุติยภูมิ
|
1
|
600
|
ก๊าซ ของเหลว ของแข็ง
|
|
แบบเร็ว
|
< 1 วินาที
|
สูง
|
สิ่งที่ได้จาก ผลิตภัณฑ์ปฐมภูมิ
|
1
|
< 600
|
ของเหลว
|
|
แบบเร็ว
|
< 1 วินาที
|
สูง
|
สิ่งที่ได้จากผลิตภัณฑ์ปฐมภูมิ
|
1
|
> 700
|
ก๊าซ
|
|
สูญญากาศ
|
2-30 วินาที
|
กลาง
|
สูญญากาศ
|
< 0.1
|
400
|
ของเหลว
|
|
ไฮโดรไพโรลิซิส
|
< 10 วินาที
|
สูง
|
ไฮโดรเจนและสิ่งที่ได้จากผลิตภัณฑ์ปฐมภูมิ
|
20
|
< 500
|
ของเหลว
|
|
เมทาโนไลซิส
|
0.5-1.5 วินาที
|
สูง
|
มีเทนและสิ่งที่ได้จากผลิตภัณฑ์ปฐมภูมิ
|
3
|
1050
|
เบนซิน
โทลูอีน
ไซลีน อีทีน
|
ที่มา : Bridgwater, AV. (1999)
เดิมปฏิกิริยาไพโรลิซิสเป็นปฏิกิริยาที่เกิดขึ้นอย่างช้าๆ และใช้อุณหภูมิต่ำเพื่อให้ได้ผลผลิตถ่านออกมามากที่สุด ต่อมามีการปรับปรุงการให้อัตราความร้อนเพิ่มขึ้นและใช้อุณหภูมิปานกลางอย่างต่อเนื่อง จนกระทั่งเกิดก๊าซ ซึ่งก๊าซนั้นจะถูกควบแน่นต่อไป และมีการสลายตัวของสารโมเลกุลใหญ่เพื่อให้ได้ปริมาณก๊าซที่มากขึ้น เชื้อเพลิงเหลวซึ่งเป็นผลิตภัณฑ์ที่ได้จากปฏิกิริยาไพโรลิซิสจะถูกนำไปวิเคราะห์ค่าต่างๆ เช่น ความหนาแน่น ความหนืด แรงตึงผิว ค่าความร้อน ผลพลอยได้จากปฏิกิริยาไพโรลิซิสที่อยู่ในรูปของก๊าซและของแข็งซึ่งเป็นสารไฮโดรคาร์บอนจำนวนมาก รวมทั้งสารโมเลกุลต่ำที่ไม่ได้ควบแน่นเป็นของเหลว การแยกเชื้อเพลิงเหลวในปฏิกิริยาไพโรลิซิสมีหลายวิธี ได้แก่ การสกัดด้วยตัวละลาย การกลั่นลำดับส่วน การชะด้วย ตัวทำละลาย ซึ่งวิธีดังกล่าวจะทำให้เชื้อเพลิงเหลวที่ได้จากปฏิกิริยาไพโรลิซิสมีสิ่งเจือปนประเภทต่างๆ ดังนี้
ก. น้ำ - ทำให้ค่าความร้อน ความหนืด ความเสถียรทางเคมีและกายภาพลดลงและการเอาน้ำออกจากเชื้อเพลิงเหลวนั้นทำได้ยาก
ข. ของแข็ง - เป็นพวกถ่านหรือเถ้า ซึ่งสามารถแยกของแข็งเหล่านี้ออกมาจากเชื้อเพลิงเหลว โดยการใช้ไอร้อนก่อนนำเชื้อเพลิงไปกลั่นตัวเป็นของเหลว
ค. ด่าง - เป็นผลมาจากเถ้าที่มีอยู่ในปฏิกิริยาซึ่งสามารถกำจัดได้โดยการกรองไอร้อนก่อนนำเชื้อเพลิงไปควบแน่นเป็นของเหลว
ง. กรด - เป็นผลมาจากสารอินทรีย์ในชีวมวลซึ่งอาจจะทำให้ถังปฏิกิริยาเกิดสนิมได้ ดังนั้น ถังปฏิกิริยาควรทำมาจากเหล็กกล้า หรือการใช้ระบบความดันเข้าช่วย
นอกจากนี้ เชื้อเพลิงเหลวที่ได้อาจมีปัญหาเกี่ยวกับคุณสมบัติในเรื่องความเสถียรเนื่องจากเชื้อเพลิงเหลวสามารถเกิดพอลิเมอร์เป็นสายยาวได้ที่อุณหภูมิมากกว่า 100 เคลวิน ซึ่งมีผลต่อความหนืดของเชื้อเพลิงเหลวที่ได้ ดังนั้นจึงควรเก็บเชื้อเพลิงเหลวที่อุณหภูมิต่ำกว่า 100 เคลวิน รวมทั้งหลีกเลี่ยงการสัมผัสกับออกซิเจน
ปฏิกิริยาไพโรลิซิสแบบเร็ว เป็นวิธีการที่ได้รับความนิยมมากที่สุด เนื่องจากเป็นการแปรรูปชีวมวล โดยอาศัยความร้อนเพื่อให้เกิดเชื้อเพลิงเหลวมากที่สุด อีกทั้งง่ายต่อการจัดการ การจัดเก็บ การขนส่งและการนำไปใช้งาน ซึ่งถือเป็นข้อได้เปรียบมากกว่าวิธี Gasification และการเผาไหม้โดยตรง ซึ่ง 2 วิธีนี้ไม่สามารถจัดเก็บหรือขนส่งได้ทันที ตลอดจนสามารถนำพลังงานที่ได้จากปฏิกิริยาไพโรลิซิสไปใช้ประโยชน์ได้อย่างกว้างขวาง อาทิ การผลิตขนาดเล็กเพื่อใช้เองในชนบท ซึ่งให้ค่าพลังงานความร้อนน้อยและการผลิตขนาดใหญ่ ซึ่งใช้วัตถุดิบเป็นไม้ มีการพัฒนาเรื่องของการเก็บและการแยกให้บริสุทธิ์ ทำให้ได้ผลิตภัณฑ์เป็นของเหลวได้แก่ เมทานอล น้ำมันดินและกรดน้ำส้ม ปัญหาที่พบได้จากปฏิกิริยาไพโรลิซิสแบบเร็วคือ การถ่ายเทความร้อนสูงให้กับวัตถุดิบ การควบคุมอุณหภูมิที่มีผลดีต่อปริมาณและคุณภาพของผลิตภัณฑ์ที่ได้และระยะเวลาในการเกิดไอควรมีค่าน้อยเพื่อให้ปฏิกิริยาไม่พึงประสงค์เกิดน้อยที่สุด ตลอดจนการควบคุมปฏิกิริยาการควบแน่นและการเก็บส่วนที่เป็นของเหลว
C. การทำให้เกิดก๊าซ (Gasification) (Chomcharn, A., 1982; Bridgwater, AV., 1999; Ptasinski, KJ., Prins, MJ., and Pierik, A., 2006)
Gasification เป็นการย่อยสลายชีวมวลโดยการให้ความร้อนกับองค์ประกอบทางเคมีของชีวมวลโดยใช้กระบวนการออกซิเดชันบางส่วน (Partial oxidation) โดยใช้ตัวออกซิไดซ์ ได้แก่ อากาศ ออกซิเจนหรือไอน้ำ จนกระทั่งเกิดผลิตภัณฑ์เป็น CO2 CO CH4 ก๊าซไฮโดรเจน (H2) ก๊าซไนโตรเจน (N2) (ในกรณีที่ใช้อากาศเป็นตัวออกซิไดซ์) และก๊าซที่มีองค์ประกอบของไฮโดรคาร์บอนเกิดขึ้นเล็กน้อย เช่น ก๊าซอีเทน ก๊าซอีทีน ตลอดจน น้ำ เขม่า เถ้า และน้ำมันดิน การให้ความร้อนกับชีวมวลโดยไม่เกิดการออกซิไดซ์จะเรียกว่า Pyrolysis แต่เมื่อนำผลิตภัณฑ์จากปฏิกิริยาไพโรลิซิสไปทำปฏิกิริยากับตัวออกซิไดซ์ (ปกติเป็นอากาศ) จะเกิดก๊าซ CO, CO2, H2 และอื่นๆ การเกิด Char gasification เป็นการรวมตัวกันของปฏิกิริยาระหว่างก๊าซและของแข็ง และปฏิกิริยาระหว่างก๊าซและก๊าซหลายๆ ปฏิกิริยารวมกันเพื่อที่จะเปลี่ยนถ่านไปเป็น CO, CO2, และ H2 โดยผ่านปฏิกิริยา Water-gas shift ซึ่งเป็นการออกซิไดซ์เพื่อเปลี่ยนจากก๊าซไปเป็นของแข็งโดยปฏิกิริยานี้เป็นปฏิกิริยาที่เกิดช้าที่สุดและเป็นตัวกำหนดอัตราการเกิดปฏิกิริยา gasification ผลิตภัณฑ์ที่ได้จากปฏิกิริยาจะเป็นก๊าซผสม โดยสัดส่วนของก๊าซแต่ละชนิด ซึ่งขึ้นอยู่กับส่วนประกอบของวัตถุดิบ ปริมาณน้ำ อุณหภูมิในการเกิดปฏิกิริยา และระยะเวลาในการออกซิไดซ์ ดังแสดงในตารางที่ 3
ตารางที่ 3 องค์ประกอบของก๊าซชนิดต่างๆ ที่ได้จากการทำให้เกิดก๊าซ (gasification) ของชีวมวลแต่ละชนิด
|
ชนิดเชื้อเพลิง
|
อุณหภูมิ(๐C)
|
ปริมาณอากาศ
กก./กก.ชีวมวล
|
องค์ประกอบของก๊าซจากgasification (เศษส่วนโมล)
|
|
H2O
|
N2
|
H2
|
CO
|
CO2
|
CH4
|
H2S
|
|
ถ่านหิน
|
832
|
2,836
|
0.005
|
0.500
|
0.158
|
0.324
|
0.009
|
0.001
|
0.003
|
|
น้ำมันพืช
|
875
|
3,837
|
0.003
|
0.467
|
0.251
|
0.275
|
0.003
|
0.001
|
0.000
|
|
ฟางข้าว
|
659
|
1,401
|
0.063
|
0.384
|
0.225
|
0.205
|
0.113
|
0.010
|
0.000
|
|
ไม้ยืนต้นมีการปรับปรุง
|
655
|
1,628
|
0.062
|
0.409
|
0.213
|
0.194
|
0.112
|
0.010
|
0.000
|
|
ไม้ยืนต้นไม่มีการปรับปรุง
|
642
|
1,452
|
0.076
|
0.380
|
0.227
|
0.177
|
0.126
|
0.013
|
0.000
|
|
ไม้ล้มลุก
|
621
|
1,240
|
0.097
|
0.363
|
0.232
|
0.146
|
0.145
|
0.018
|
0.000
|
|
น้ำทิ้ง
|
600
|
1,237
|
0.186
|
0.412
|
0.192
|
0.056
|
0.147
|
0.004
|
0.003
|
|
มูลสัตว์
|
600
|
1,247
|
0.246
|
0.395
|
0.171
|
0.018
|
0.147
|
0.002
|
0.001
|
ที่มา : Ptasinski, KJ., Prins, MJ., and Pierik, A. (2006)
การเกิดปฏิกิริยา Gasification มีด้วยกันหลายระบบโดยแยกตามการเข้า-ออกของชีวมวลและก๊าซที่เข้าไปในปฏิกิริยาดังนี้
- Updraft gasification เป็นการป้อนชีวมวลจากด้านบนลงด้านล่างของถังปฏิกิริยา (Gasifier) เพื่อให้ทำปฏิกิริยากับตัวออกซิไดซ์ทางด้านล่างเพื่อให้เกิดผลิตภัณฑ์เป็นถ่าน จากนั้นถ่านจะถูกนำไปทำปฏิกิริยาต่อไปจนเกิดเป็นก๊าซผสมระหว่างน้ำมันดินและไฮโดรคาร์บอนที่มีค่าความร้อนสูงซึ่งจะออกทางด้านบน และสุดที่เป็นเถ้าจะออกทนำไปทิ้งทางด้านล่างของ Gasifier ซึ่งก๊าซที่ได้นี้จะถูกนำไปทำให้บริสุทธิ์ต่อไป วิธีนี้เชื้อเพลิงที่ได้มีราคาถูกเหมาะกับการนำไปผลิตเป็นกระแสไฟฟ้า ต้องการพื้นที่น้อย การดำเนินการง่าย มีประสิทธิภาพสูง ก๊าซที่ได้มีอุณหภูมิต่ำและความร้อนที่ได้จากก๊าซสามารถนำไปให้ความร้อนกับวัตถุดิบได้โดยตรง
- Downdraft gasification คล้ายกับการเกิดปฏิกิริยา Updraft gasification แต่เนื่องจากการที่ให้ไอน้ำมันดินออกทางด้านบนจะไปรบกวนการเผาไหม้ภายใน ดังนั้นวิธีการนี้จึงให้ก๊าซผสมระหว่างน้ำมันดินและไฮโดรคาร์บอนซึ่งเป็นผลิตภัณฑ์ที่ได้จากปฏิกิริยานี้ออกด้านล่างโดยการให้อากาศลงด้านล่างผ่านถังหมักแล้วให้ก๊าซออกด้านล่าง เป็นการให้วัตถุดิบและก๊าซผ่านจุดที่แคบซึ่งเป็นจุดที่เกิดปฏิกิริยา ซึ่งวิธีการนี้เป็นวิธี ที่ง่ายและน่าเชื่อถือ อีกทั้งมีปริมาณเถ้าและน้ำมันน้อย สามารถนำไปใช้กับการเผาไหม้ในรถยนต์และการผลิตกระแสไฟฟ้าในปริมาณที่ไม่มากได้ (Chomcharn, A., 1982; Bridgwater, AV., 1999)
กระบวนการ Gasification มักมีสิ่งปนเปื้อนอยู่ด้วย จึงจำเป็นต้องนำก๊าซผสมที่ได้ไปทำให้บริสุทธิ์ก่อนจึงจะนำก๊าซไปใช้ประโยชน์ได้ต่อไป ซึ่งปริมาณของสิ่งปนเปื้อนนั้นขึ้นอยู่กับวิธีการ Gasification และวัตถุดิบที่ใช้ในการผลิต การทำให้ก๊าซบริสุทธิ์เป็นการป้องกันการกัดกร่อน การระเบิด และผลกระทบที่จะเกิดต่อสิ่งแวดล้อม นอกจากนี้แล้วยังมีการปนเปื้อนของน้ำมันดินซึ่งปริมาณของน้ำมันดินนั้นขึ้นอยู่กับอุณหภูมิและวัตถุดิบในกระบวนการ Gasification โดยน้ำมันดินจะมีปริมาณลดลงเมื่ออุณหภูมิในการทำปฏิกิริยาเพิ่มขึ้น และพบว่า วัตถุดิบที่เป็นไม้จะให้ปริมาณน้ำมันดินมากกว่าวัตถุดิบที่เป็นถ่านหิน ซึ่งการลดปริมาณน้ำมันดินสามารถทำได้หลายวิธีคือ ใช้ตัวเร่งปฏิกิริยา เช่น โดโลไมด์ (Dolomite) นิกเกิล (Nickel) การให้ความร้อน การถูด้วยน้ำ น้ำมัน และการตกตะกอนด้วยวิธีทางไฟฟ้าสถิตย์ นอกจากนี้ ยังมีสารปนเปื้อนอื่นๆ ออกมากับก๊าซซึ่งสามารถกำจัดได้โดยใช้วิธีที่แตกต่างกันดังนี้
- โลหะแอลคาไลด์ (alkali metal) ทำให้เกิดการกัดกร่อนของใบพัด ซึ่งสามารถกำจัดออกได้โดยใช้การถูด้วยน้ำ
- ไนโตรเจน เป็นสารที่ก่อให้เกิดก๊าซออกไซด์ของไนโตรเจน (NOx) ปล่อยสู่ชั้นบรรยากาศ ซึ่งสามารถกำจัดออกได้โดยใช้การถูด้วยน้ำ
- กำมะถัน สร้างความเสียหายแก่ใบพัด กำจัดออกได้โดยใช้ dolomite
- คลอรีน เป็นสารปนเปื้อนจากยาฆ่าแมลงที่มีอยู่ในชีวมวล กำจัดออกได้โดยการดูดในถังหรือการละลายในระบบเปียก
ก๊าซบริสุทธิ์ที่ได้ต้องมีการเติมไอน้ำลงไปในก๊าซเพื่อให้เกิดปฏิกิริยา Shift conversion ซึ่งจะเปลี่ยนจาก CO2 ไปเป็น H2 โดยปริมาณไอน้ำที่เติมลงไปขึ้นอยู่กับสัดส่วนของที่ก๊าซผสมใน Gasification จากนั้นจึงทำการแยก H2 ให้บริสุทธิ์ โดยใช้วิธีทางเคมีคือ ตัวดูดซับทางเคมีและวิธีการทางฟิสิกส์ เพื่อให้ได้ไอน้ำและ H2 ก่อนเอาน้ำออกด้วยการควบแน่น (Bridgwater, AV., 1999) กระบวนการ Gasification เมื่อใช้อากาศเป็นตัวออกซิไดซ์จะทำให้เชื้อเพลิงที่ได้มีค่าความร้อนต่ำถึงปานกลางคิดเป็น 10-15% ของพลังงานที่ได้จากก๊าซธรรมชาติ ซึ่งเหมาะสำหรับการนำไปใช้ประโยชน์ในการหุงต้มอาหาร ให้ความร้อน ใช้ในเครื่องยนต์ ใบพัด หม้อต้มน้ำ แต่ไม่เหมาะในการขนส่งทางท่อ นอกจากนี้ ก๊าซที่ได้นี้ยังสามารถนำไปเปลี่ยนเป็นน้ำมันเบนซิน เมทานอล H2 และใช้ในเซลล์เชื้อเพลิงซึ่งจะให้ค่าทางความร้อนปานกลาง วิธีการนี้ใช้กันอย่างกว้างขวางเพราะราคาถูกและ ไม่มีอันตราย ไม่ซับซ้อน กระบวนการ gasification นี้นิยมใช้กันอย่างมากในทวีปยุโรปและอเมริกาเหนือ
ปัจจุบันมีการนำ H2 และ CO ที่อุณหภูมิสูง (700-1500°C) ซึ่งเป็นก๊าซที่ได้จากกระบวนการ Gasification นำมาทำให้บริสุทธิ์และปรับสภาพให้เหมาะสม จากนั้นนำไปผลิตเป็นน้ำมันดีเซลโดยวิธี Fischer-Tropsch process ซึ่งวิธีการนี้เป็นการนำเอาก๊าซที่ได้ไปสร้างเป็นไฮโดรคาร์บอนสายยาว เช่น LPG เบนซิน ดีเซล น้ำมันเตา โดยใช้เหล็กและโคบอลต์เป็นตัวเร่งปฏิกิริยาภายใต้อุณหภูมิและความดันสูง จากนั้นนำไฮโดรคาร์บอนที่ได้ไปกลั่นเพื่อทำให้บริสุทธิ์สำหรับใช้เป็นน้ำมันเชื้อเพลิง โดยเชื้อเพลิงที่ได้มีคุณภาพดีและเป็นเชื้อเพลิงสะอาดเนื่องจากมีกำมะถันและสารประกอบอะโรเมติกส์น้อย (Laohalidanond, K., 2007)
D. กระบวนการหมัก (fermentation) (Hertzmark, D., 1982; Choorit, W. and Wisarnwan, P., 2007)
การหมัก เป็นวิธีการที่รู้จักกันมาเป็นเวลานานแล้ว ดังมีหลักฐานปรากฏในสมัยก่อนที่มนุษย์ได้นำการหมักมาใช้ประโยชน์มากมาย เช่น การหมักข้าว ผลไม้ เพื่อผลิตเบียร์และไวน์ การทำขนมปังและนม มีการพัฒนาวิธีในการหมักอย่างต่อเนื่อง โดยนำการกลั่นเข้ามาช่วยเพิ่มประสิทธิภาพในการหมัก สำหรับการหมักเพื่อผลิตพลังงานนี้ เริ่มจากนำชีวมวล เช่น มันสำปะหลัง กากของปาล์มน้ำมันและสาหร่าย มาทำการหมักโดยไม่ใช้ออกซิเจนเพื่อให้ได้สารโมเลกุลเล็ก เช่น เอทานอล และ CH
4 การหมักเป็นการย่อยสลายชีวมวลโดยไม่ใช้ออกซิเจน จัดเป็นกระบวนการทางชีวเคมีที่เปลี่ยนสารประกอบอินทรีย์ไปเป็น CH
4 และ CO
2 ปัจจัยสำคัญของการหมักคือ ความคงตัว ลักษณะของถังหมัก เวลา อัตราการป้อนวัตถุดิบ ความเป็นกรด-ด่าง (
pH) อุณหภูมิ ความเข้มข้นของผลิตภัณฑ์ ความเข้มข้นของกรดไขมัน และส่วนประกอบของวัตถุดิบ เมื่อเสร็จสิ้นการหมักแล้วยังสามารถนำชีวมวลจากการหมักไปใช้ทำปุ๋ยได้ การหมักสามารถจำแนกได้ 2 วิธีตามผลิตภัณฑ์ที่ได้คือ
1. การหมักเพื่อให้ได้เอทานอล (Hall, DO. and Rosillo – Calle, F., 1999) การหมักเอทานอลเป็นการแก้ปัญหาเรื่องน้ำมันแพงและช่วยเพิ่มมูลค่าให้กับชีวมวล เอทานอลที่ได้นี้เป็นพลังงานสะอาดและไม่ก่อให้เกิดก๊าซพิษ สามารถไปใช้ในเครื่องยนต์ได้ การหมักเพื่อให้ได้เอทานอลสามารถใช้วัตถุดิบได้หลายชนิด เช่น อ้อย มันสำปะหลัง และพืชที่มีองค์ประกอบของเซลลูโลส ซึ่งแต่ละวิธีมีรายละเอียดดังนี้
- การผลิตเอทานอลจากอ้อย หรือ ข้าวโพด ซึ่งอ้อยและข้าวโพด เป็นวัตถุดิบหลักที่ใช้ในการผลิตเอทานอลโดยการนำอ้อยหรือข้าวโพดไปหมักแบบต่อเนื่องด้วยยีสต์ จากนั้นนำไปกลั่นภายใต้ความดันต่ำ ซึ่งเอทานอล 1 ลิตรให้กระแสไฟฟ้า 0.15-0.18 กิโลวัตต์ต่อชั่วโมง (Hall, DO. and Rosillo – Calle, F., 1999)
- การผลิตเอทานอลจากพืชที่มีองค์ประกอบของเซลลูโลส จะต้องมีการย่อย 2 วิธีด้วยกัน คือการย่อยด้วยกรด (Acid hydrolysis) ซึ่งให้ประสิทธิภาพที่ดีกับไม้เนื้ออ่อนและไม้เนื้อแข็ง ในขณะที่อีกวิธีหนึ่ง คือ การย่อยด้วยเอนไซม์ (Enzymatic hydrolysis) จะให้ผลดีกับไม้เนื้อแข็งและพืชสมุนไพร การใช้เอนไซม์มีความเป็นมิตรต่อสิ่งแวดล้อมมากกว่าการใช้กรดและให้ผลผลิตสูงกว่า การหมักในโรงงานอุตสาหกรรมนิยมใช้การย่อยด้วยกรดมากกว่าการใช้เอนไซม์ และการใช้เอนไซม์จะต้องมีการบ่มก่อนจึงจะให้ผลผลิตที่สูงแต่การบ่มจะทำให้เสียค่าใช้จ่ายสูง หลังจากผ่านการย่อยแล้ว ผลิตภัณฑ์ที่ได้เป็นคาร์โบไฮเดรตซึ่งจะถูกนำไปหมักด้วยจุลินทรีย์ เช่น แบคทีเรีย ยีสต์ และราต่อไป จุลินทรีย์เหล่านี้จะทำหน้าที่เปลี่ยนคาร์โบไฮเดรตไปเป็นเอทานอลภายใต้สภาวะที่ไม่มีออกซิเจน (Hall, DO. and Rosillo – Calle, F., 1999)
- การผลิตเอทานอลจากพืชมันสำปะหลัง โดยเริ่มต้นจากการนำแป้งมันสำปะหลังไปต้มเคี่ยวด้วยเอนไซม์อะไมเลสที่อุณหภูมิ 120-150°C แล้วให้อุณหภูมิคงที่ที่ 95°C เพื่อลดเชื้อแบคทีเรียในน้ำแป้งต้มสุกนั้นเรียกกระบวนการนี้ว่า Liquefaction จากนั้นนำไปผ่านกระบวนการ Saccharification ซึ่งเป็นการนำแป้งต้มสุกที่เย็นตัวแล้ว นำไปย่อยด้วยเอนไซม์กลูโคอะไมเลสเพื่อย่อยแป้งให้กลายเป็นน้ำตาลก่อนนำไปหมัก การหมักจะใช้ Saccaromycese cerevisiae บ่มเป็นเวลา 48 ชั่วโมงที่ pH 4-5 แล้วนำไปกลั่นจนได้เอทานอล 95% นอกจากการกลั่นแล้ว ยังมีวิธีในการทำให้เอทานอลบริสุทธิ์ได้หลายวิธี เช่น การใช้เมมเบรน หรือ ตัวดูดซับ และการสกัดด้วยตัวทำละลาย (สิทธิศักดิ์ อุปริวงศ์, ปิยะเมธ ทองละมุน และสำรวย นางทะราช, 2548)
- การผลิตเอทานอลจากการหมักก๊าซ โดยใช้เชื้อแบคทีเรียในกลุ่ม Clostridium โดยก๊าซที่นำมาหมักนี้ได้ผ่านกระบวนการ Gasification ประกอบด้วยก๊าซ CO, CO2 ,CH4 , H2 , N2 ซึ่งก๊าซเหล่านี้จะถูกเปลี่ยนไปเป็นเอทานอลโดยวิธีการหมัก การหมักมีความเกี่ยวข้องกับปฏิกิริยาชีวเคมีภายในเซลล์ที่เรียกว่า Acetyl-CoA pathway ดังสมการต่อไปนี้
จากสมการที่ (1) และ (2) พบว่า เมื่อมี CO ซึ่งเกิดจากกระบวนการ gasification เพียงอย่างเดียว จำนวนคาร์บอนที่จะเปลี่ยนไปเป็นเอทานอลมีเพียง 1 ใน 3 เท่านั้น โดยใช้เอนไซม์ carbonmoxoxide dehydrogenase กับ CO2 ส่วนปฏิกิริยาระหว่าง H2 กับ CO2 นั้น พบว่า คาร์บอนทุกตัวสามารถเปลี่ยนไปเป็นเอทานอลได้ทั้งหมดและเมื่อนำสมการที่ (1) และ (2) มารวมกันจะได้เป็นสมการที่ (3) ดังนี้
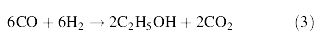
จากสมการที่ (3) พบว่า มีคาร์บอนจำนวน 2 ใน 3 ถูกเปลี่ยนไปเป็นเอทานอลโดย 2 สมการหลังนี้จะเกิดขึ้นจากการใช้เอนไซม์ Hydrogenase ดังนั้นปริมาณเอทานอลที่ได้จะขึ้นอยู่กับสัดส่วนขององค์ประกอบของก๊าซที่นำมาหมัก อีกทั้งปริมาณ H2 มีค่าน้อยกว่าที่คาดไว้เนื่องจากมีบางส่วนทำปฏิกิริยากับชีวมวลที่เป็นคาร์บอนเพื่อเปลี่ยนเป็นเอทานอล (Datar, RP., et al., 2004)
2. การหมักเพื่อให้ได้ก๊าซมีเทน การหมักเพื่อให้ได้ CH4 นั้นสามารถนำชีวมวลต่างๆ มาหมักได้ เช่น มูลสัตว์และขยะสด ในที่นี้จะขอยกตัวอย่างการผลิต CH4 จากการหมักเศษเหลือทิ้งจากปาล์มน้ำมัน ซึ่งน้ำมันที่มีอยู่ในปาล์มนั้นจะถูกเปลี่ยนไปเป็นกรดไขมันโดยจุลินทรีย์ จากนั้นกรดไขมันจะถูกเปลี่ยนไปเป็น CH4 เศษเหลือทิ้งที่มีองค์ประกอบเป็นกรดไขมันสายยาว เช่น Palmitic oleate จะเป็นตัวยับยั้งการเจริญเติบโตของเชื้อแบคทีเรีย และการเกิดก๊าซมีเทน การลดค่า COD จะทำให้เกิดไบโอก๊าซและ CH4 ซึ่งจะทำให้ต้นทุนการหมักแบบไม่ใช้ออกซิเจนลดลง (Choorit, W. and Wisarnwan, P., 2007)
E. การผลิตไบโอดีเซล (Hossain, ABMS., et al., 2008)
สาหร่ายสามารถใช้เป็นวัตถุดิบในการผลิตไบโอดีเซลได้เนื่องจากมีประสิทธิภาพในการให้ผลผลิตที่สูงกว่าชีวมวลชนิดอื่น โดยให้ผลผลิตสูงกว่าน้ำมันถั่วเหลืองถึง 250 เท่าและผลผลิตสูงกว่าปาล์ม 7-31 เท่า อีกทั้งการแยกน้ำมันให้บริสุทธิ์สามารถทำได้ง่าย โดยการนำสาหร่ายมาผลิตเป็นเชื้อเพลิงมีขั้นตอนดังนี้
1. เก็บตัวอย่างสาหร่ายสายพันธุ์ Oedogonium และ Spirogyra sp. จำนวน 26.5 กรัม และ 20.0 กรัม ตามลำดับ
2. นำสาหร่ายมาบด แล้วทำให้แห้งที่อุณหภูมิ 80 °C เป็นเวลา 20 นาที
3. ใช้ตัวทำละลายผสมของเฮกเซนและอีเทอร์เป็นตัวสกัดน้ำมัน โดยตั้งทิ้งไว้ 24 ชั่วโมง
4. กรองเพื่อแยกส่วนที่เป็นสาหร่ายออกไป
5. แยกชั้นของตัวทำละลายและทำการระเหยให้แห้ง
6. ใส่โซเดียมไฮดรอกไซด์ 0.25 กรัมผสมลงไปในเมทานอล 24 มิลลิลิตร คนให้เข้ากันเป็นเวลา 20 นาที
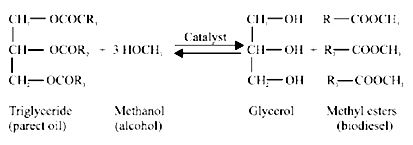
7. นำตัวทำละลายผสมในข้อ 5 เติมลงในสิ่งสกัดจากสาหร่าย นำไปเขย่าเป็นเวลา 16 ชั่วโมง เพื่อให้เกิดปฏิกิริยา Transesterification ดังสมการที่แสดงข้างล่างนี้
8. นำไปโอดีเซลที่ได้ไปล้างด้วยน้ำ 5% จนกว่าจะสะอาด แล้วนำไปทำให้แห้ง 12 ชั่วโมง
การนำพลังงานจากชีวมวลไปใช้ประโยชน์ (Hinrich, RA. and Kleinbach, M., 2002; Loehr, J., et al., 1984)
ผลิตภัณฑ์ที่ได้จากชีวมวลด้วยเทคโนโลยีต่างๆนั้นมีอยู่หลายชนิดด้วยกัน ดังนี้
1. เอทานอล (C2H5OH) เป็นของเหลวไม่มีสีมีจุดเดือดอยู่ที่ 78 °C ในที่นี้หมายถึง เกรนแอลกอฮออล์(Grain alcohol) หรือเอทิลแอลกอฮอล์ (Ethyl alcohol) ซึ่งผลิตได้จากอ้อย ข้าวโพดและไม้ เอทานอลช่วยปรับปรุงสมรรถนะของเครื่องยนต์ (Vehicle performance) ปล่อยก๊าซพิษน้อยกว่าน้ำมันเบนซิน แต่ต้นทุนการผลิตเอทานอลสูงกว่าปิโตรเลียม เอทานอลสามารถนำมาใช้เป็นพลังงานเชื้อเพลิงได้เลยหรือสามารถนำไปใช้ร่วมกับน้ำมันเบนซินได้ ยกตัวอย่าง เช่น น้ำมัน E10 หมายถึง น้ำมันที่มีส่วนผสมของเอทานอลอยู่ 10% และน้ำมันเบนซิน 90% ซึ่งจะช่วยลดการปลดปล่อย CO ได้ถึง 25-30% อีกทั้งช่วยลดการปลดปล่อย CO2 และ NO2 ได้ 10 และ 20% ตามลำดับ นอกจากนี้เอทานอลยังถูกนำมาใช้แทน MTBE (Methyl tertiary butyl ether) ซึ่งใช้เป็นสารตัวเติมในน้ำมันเบนซินได้อีกด้วย ในประเทศบราซิลจะใช้แอลกอฮอล์บริสุทธิ์ในการเติมรถยนต์ โดยไม่มีการปรับเปลี่ยนเครื่องยนต์ และในประเทศอเมริกามีการใช้พลังงานจากข้าวโพดถึง 1 ใน 8 ของปริมาณข้าวโพดทั้งหมด ในประเทศอาร์เจนตินามีการผลิตเอทานอลในระดับใหญ่ รวมทั้งอีกหลายประเทศมีการผลิต เอทานอลระดับเล็ก เช่น ประเทศเยอรมัน อิตาลี สวีเดน ฝรั่งเศส เคนยาและประเทศซิมบับเว ส่วนในประเทศจีนมีการกระตุ้นให้มีการนำพลังงานทดแทนมาใช้ทางการค้าและใช้ในทางอุตสาหกรรม (Datar, RP., et al., 2004)
ข้อดีของการใช้เอทานอลมาผลิตเป็นพลังงาน (Hall, DO. and Rosillo – Calle, F., 1999) คือ
(1)ได้จากชีวมวลหลากหลายชนิดเช่น อ้อย บีท ข้าวโพด ข้าวฟ่าง และมันสำปะหลัง
(2) ทำให้มีการจ้างงานมากขึ้นและลดการอพยพย้ายถิ่นฐานเมื่อเปรียบเทียบกับการใช้พลังงานจากเชื้อเพลิงฟอสซิล
(3) เทคโนโลยีเริ่มเป็นที่รู้จักและเปิดกว้างให้สามารถเข้าถึงได้ทำให้สามารถมีการพัฒนาเทคโนโลยีให้กว้างหน้ามากยิ่งขึ้นได้
(4) ความสมดุลของพลังงานในชีวมวลต่างๆ มีค่าสูง
(5) ผลพลอยได้ (ฺBy product) สามาถนำไปทำประโยชน์ได้ เช่น นำไปทำปุ๋ย
(6) เอทานอลเป็นพลังงานทดแทนที่สามารถหาใหม่ได้ไม่มีวันหมดและลดการปลดปล่อย CO2 ออกสู่ชั้นบรรยากาศ
(7) มีความปลอดภัยในการดำเนินงานและดูแลจัดเก็บได้ง่ายกว่าเชื้อเพลิงฟอสซิล
(8) สามารถนำไปผสมกับน้ำมันชนิดอื่นได้ เช่น น้ำมันเบนซิน
(9) สามารถเพิ่มค่าออกเทนในน้ำมันเบนซินโดยนำมาใช้ทดแทนสารตะกั่วเพื่อลดสารประกอบอะโรมาติกส์ ซึ่งจะเป็นการช่วยลดมลพิษและเป็นการลดต้นทุนได้อีกด้วย
การหมักเพื่อให้เกิดเอทานอลยังต้องมีการพัฒนาต่อไปเพื่อทำให้มีต้นทุนในการผลิตน้อยที่สุด ซึ่งเป็นแรงจูงใจให้คนหันมาใช้พลังงานจากเอทานอลกันมากขึ้นแต่จะต้องมีการพัฒนาอีกหลายประการ เช่น การหาสายพันธุ์แบคทีเรียชนิดใหม่ที่สามารถให้ผลผลิตเอทานอลในปริมาณสูง การทำเอทานอลให้บริสุทธิ์ เทคโนโลยีการกลั่น การลดการเกิดกรดในกระบวนการหมัก การใช้วัตถุดิบในกระบวนการหมักให้ยาวนานขึ้น การลดต้นทุนในการบ่มของเอนไซม์ให้น้อยลง การพัฒนาวิธีในการแยกลิกนินออกจากวัตถุดิบได้อย่างมีประสิทธิภาพสำหรับการหมักพืชที่มีลิกนินเป็นองค์ประกอบ และการสร้างโรงงานผลิตแบบต่อเนื่องและลดต้นทุนด้านการดำเนินการ
2. เมทานอล (CH3OH) เป็นของเหลวไม่มีสีมีจุดเดือดอยู่ที่ 65 °C เรียกอีกอย่างว่า วู๊ดแอลกอฮอล์ (Wood alcohol) หรือเมทิลแอลกอฮอล์ (Methyl alcohol) สามารถผลิตได้จากชีวมวลที่มีคาร์บอนเป็นองค์ประกอบ ถ่านหินและก๊าซธรรมชาติ ประเทศเยอรมันใช้เมทานอลตั้งแต่ในสงครามโลกครั้งที่ 2 สำหรับเครื่องบินและเรือดำน้ำและใช้เพื่อการเผาไหม้ภายในเครื่องยนต์ หรือ เป็นเชื้อเพลิงในรถแข่ง เมทานอลจากก๊าซธรรมชาติ ถือได้ว่าราคาถูกที่สุด เชื้อเพลิงเมทานอลสามารถผลิตได้จากชีวมวลเกือบทุกชนิดและสามารถนำไปผสมกับน้ำมันเบนซินร้อยละ 15 เพื่อใช้ในเครื่องยนต์โดยไม่ต้องมีการปรับแต่ง แต่เมทานอลไม่สามารถใช้ทดแทนเชื้อเพลิงฟอสซิลได้เนื่องจากวัตถุดิบมีราคาสูงและความไม่คุ้มทุน แต่มีการศึกษาการนำเมทานอลไปใช้ในรถยนต์ ซึ่งในทวีปยุโรปจะมีการนำใช้ในรถยนต์ปี ค.ศ. 2010 (Hinrich, RA. and Kleinbach, M., 2002; Hall, DO. and Rosillo – Calle, F., 1999)
3. เชื้อเพลิงไฮโดรเจน (Hydrogen fuel) เป็นเชื้อเพลิงสะอาดผลิตได้จากก๊าซธรรมชาติ (จากการที่นำ CH4 ทำปฏิกิริยากับไอน้ำแล้วได้ CO2 และ H2) ถ่านหินหรือการแยกน้ำด้วยไฟฟ้า (Electrolysis of water) ซึ่งเชื้อเพลิงที่ได้จากก๊าซธรรมชาติมีราคาถูกที่สุด เชื้อเพลิงไฮโดรเจนสามารถใช้กับเครื่องยนต์เบนซินปกติได้แต่จะให้ประสิทธิภาพที่ดีมากขึ้นเมื่อใช้กับเครื่องยนต์ที่ผ่านการดัดแปลงแล้ว เชื้อเพลิงไฮโดรเจนจะถูกเก็บในรูปของก๊าซภายใต้ความดันสูง ไฮโดรเจนเหลวหรือโลหะไฮไดรด์ (Metal hydride) การใช้พลังงานจากเชื้อเพลิงไฮโดรเจนจะต้องศึกษาต้นทุนและผลผลิตที่ได้ ซึ่งจะต้องทำให้มีต้นทุนที่ต่ำและให้ผลผลิตสูงจึงสามารถนำไปใช้เป็นเชื้อเพลิงในการขนส่งได้อย่างมีประสิทธิภาพ นอกจากนี้ยังต้องมีการพัฒนาวิธีการผลิต การเปลี่ยนรูปพลังงาน การจัดเก็บ การขนส่งและการนำไปใช้ประโยชน์ (Hall, DO. and Rosillo – Calle, F., 1999)
4. เซลล์เชื้อเพลิง (Fuel cell) เป็นการสร้างกระแสไฟฟ้าโดยใช้การรวมตัวกันของ H2 และ O2 พบว่ามีการใช้กันอย่างกว้างขวางในรถยนต์ (Hinrich, RA. and Kleinbach, M., 2002)
5. ไดเมทิลอีเทอร์ (Dimethyl ether) เป็นเชื้อเพลิงที่น่าสนใจเนื่องจากมีความเหมาะสมกับความต้องการที่หลากหลาย เช่น การนำไปหุงต้มอาหาร การให้ความร้อน การนำไปผลิตเชื้อเพลิงสำหรับการขนส่งและการนำไปผลิตกระแสไฟฟ้า ในประเทศจีนมีการนำ Dimethyl ether จากถ่านหินมาใช้ประโยชน์ในการหุงต้มอาหารซึ่งมีคุณสมบัติเหมือนกับ LPG โดยในสภาวะปกติ Dimethyl ether จะมีสถานะเป็นก๊าซ ซึ่งสามารถนำไปเก็บภายใต้ความดันที่ไม่รุนแรง นอกจากนี้ Dimethyl ether ยังใช้เป็นเชื้อเพลิงในรถยนต์ได้เนื่องจาก Dimethyl ether มีค่าซีเทนสูง (การจุดติดด้วยแรงอัด) การเผาไหม้ที่ปราศจากเขม่าและมีการปลดปล่อย NO2 น้อยซึ่งเป็นก๊าซเรือนกระจกที่ทำให้เกิดภาวะโลกร้อน (Jingjing, L., et al., 2001)
6. ไบโอดีเซล (Biodiesel) มีสมบัติคล้ายดีเซลปกติโดยสามารถนำไปใช้กับเครื่องยนต์ปกติได้ ซึ่งไบโอดีเซลสามารถผลิตได้จากพืชในตระกูลละหุ่ง ถั่วเหลือง ปาล์ม ดอกทานตะวัน น้ำมันจากสาหร่าย นอกจากนี้ ไบโอดีเซลยังสามารถผลิตได้จากน้ำมันประเภทต่างๆ ข้างต้นที่ผ่านการใช้งานมาแล้วได้อีกด้วย แต่มีการจำกัดอยู่เฉพาะในบางพื้นที่เท่านั้นเนื่องจากตลาดมีขนาดเล็กและใช้ในบางท้องถิ่นเนื่องจากมีต้นทุนสูงและความสามารถในการผลิตไม่เพียงพอ โดยนำไปใช้ในการให้แสงสว่าง ปั้มน้ำ ไบโอดีเซลเป็นเชื้อเพลิงที่ป็นมิตรกับสิ่งแวดล้อมเนื่องจากไม่มีกำมะถันและอนุภาคขนาดเล็ก รวมทั้งยังสามารถย่อยสลายได้ตามธรรมชาติด้วย ไบโอดีเซลเป็นสารในกลุ่ม Monoalkylester ซึ่งเกิดจากปฏิกิริยา Transesterification ระหว่าง Triglyceride และ Monohydric alcohol (Hossain, ABMS., et al., 2008; Hall, DO. and Rosillo – Calle, F., 1999)
7. ไบโอก๊าซ (Biogas) สามารถผลิตได้จากการหมักโดยไม่ใช้ออกซิเจนของอินทรีย์วัตถุ มีระบบการผลิตที่ง่ายไม่สลับซับซ้อน สามารถผลิตได้ทั้งในระดับเล็กและใหญ่ ไบโอก๊าซนำไปใช้ประโยชน์ได้ในการให้ความร้อนและใช้ในเครื่องยนต์ สามารถผลิตจากวัตถุดิบหลายชนิดเช่น มูลสัตว์และกากอุตสาหกรรรมในประเทศจีนประสบความสำเร็จในการผลิตไบโอก๊าซจากชีวมวลในระดับกลางและระดับใหญ่จากโรงงานอุตสาหกรรมและกากเหลือทิ้งอินทรีย์ ซึ่งทำในฟาร์มเลี้ยงสัตว์โดยการหมักที่อุณหภูมิห้องและมีการกำจัดกำมะถันออกก่อนนำไปใช้ จากนั้นนำสิ่งที่เหลือจากการผลิตไบโอก๊าซไปทำเป็นปุ๋ยได้อีกด้วยแต่ยังต้องมีการศึกษาเพิ่มเติมในเรื่องประสิทธิภาพของพลังงานเทคโนโลยีและความคุ้มทุน (Hall, DO. and Rosillo – Calle, F., 1999)
คุณสมบัติที่สำคัญของเชื้อเพลิงชีวมวลที่จะนำมาใช้ผลิตพลังงาน
1. พลังงานและค่าความร้อนของเชื้อเพลิงชีวมวล (Energy content , heating value or calorific value) ค่าความร้อนสามารถวัดได้ง่ายที่สุดสำหรับการเผาไหม้โดยตรงโดยทำการวัดอุณหภูมิบริเวณเตาเผา แต่ค่าความร้อนที่นิยมนำมาเปรียบเทียบประสิทธิภาพความร้อนสำหรับการเผาไหม้โดยตรง คือ Heating value หรือ Calorific value ซึ่งหมายถึงการนำชีวมวลไปเผาแล้ววิเคราะห์ว่าชีวมวลนั้นให้พลังงานปริมาณเท่าไร มีหน่วยเป็นกิโลจูล หรือ แคลอรี่ต่อชีวมวล 1 กิโลกรัม สหภาพยุโรปได้มีการแบ่งมาตรฐานประสิทธิภาพในการให้พลังงานออกเป็น 4 ระดับ ดังแสดงในตารางที่ 4 (Malatak, J., et al., 2007)
ตารางที่ 4 ระดับการปลดปล่อยพลังงานของชีวมวล
|
ระดับ
|
ประสิทธิภาพการปลดปล่อยพลังงาน (%)
|
|
ระดับ 1
|
≥70
|
|
ระดับ 2
|
≥60 <70
|
|
ระดับ 3
|
≥50 <60
|
|
ระดับ 4
|
≥30 < 50
|
ที่มา : Malatak, J., et al (2007)
สำหรับการทำให้เกิดก๊าซนั้นค่าที่นิยมนำมาเปรียบเทียบเพื่อแสดงถึงประสิทธิภาพของชีวมวลนั้น ได้แก่ ค่าความร้อน (Heating value) ระหว่างชีวมวลที่ให้เข้าไปกับก๊าซที่ปล่อยออกมารวมทั้งพลังงานทางเคมี (Chemical energy) ซึ่งคำนวณจากค่าความร้อนและอัตราส่วนขององค์ประกอบทางเคมี (Mass fraction) ถ้าจะพิจารณาลงไปให้ละเอียดยิ่งขึ้นจำเป็นต้องคำนึงถึงค่าต่างๆ ทาง Stoichiometry ด้วย เช่น ปริมาณออกซิเจนที่ได้จากการคำนวณ (Theoretical amount of oxygen) ปริมาณของอากาศที่ใช้ในการเผาไหม้แบบสมบูรณ์ (Air for ideal combustion) ปริมาณก๊าซแห้งที่ไม่ได้ใช้ในการคำนวณ (Theoretical volume amount of dry waste gas) และค่าอื่นๆ ควรตรวจสอบองค์ประกอบชีวมวลที่มีผลต่อค่าทาง Stoichiometry ได้แก่ คาร์บอน (C) ไฮโดรเจน (H) ออกซิเจน (O) ซัลเฟอร์ (S) ไนโตรเจน (N) และน้ำ แล้วดูค่าการเผาไหม้ เช่น การวัดอุณหภูมิที่อยู่ล้อมรอบ (Temperature of surrounding) และอุณหภูมิของก๊าซที่ไม่ได้ใช้ (Waste gas temperature) แล้วนำไปวัดสมบัติการเผาไหม้ เช่น เชื้อเพลิงที่สูญเสียไป (Flue loss ) ประสิทธิภาพทางความร้อนในการเผาไหม้ (Thermal technical effective of combustion) และปริมาณอากาศที่ต้องเติมเพิ่ม (Air surplus amount) ซึ่งเป็นค่าที่สำคัญสำหรับวัดการปลดปล่อยและประสิทธิภาพในการให้ความร้อน รวมทั้งยังทำให้ทราบถึงปริมาณออกไซด์ และอุณหภูมิของเตาอีกด้วย
2. ความหนาแน่นของเชื้อเพลิงชีวมวล (Density) เชื้อเพลิงชีวมวลส่วนมากจะมีความหนาแน่นต่ำและมีความชื้นสูงไม่เหมาะสำหรับการนำไปเผาไหม้ทันที ต้องผ่านการทำให้มีความหนาแน่นสูงก่อน โดยการบีบอัดเป็นก้อนซึ่งจะทำให้จัดการได้ง่ายขึ้น อีกทั้งลดจำนวนการขนส่ง และการจัดเก็บลงได้ด้วย (Jamradloedluk, J. and Wiriyaumpaiwong, S., 2007)
3. ลักษณะทางเคมีของเชื้อเพลิงชีวมวล (Chemical characteristic of biomass) (Laohalidanond, K., 2007) สำหรับการแปรรูปชีวมวลไปเป็นพลังงานโดยความร้อนวิธีใดก็ตาม เช่น การเผาไหม้โดยตรง การทำให้เกิดก๊าซ และการเผาไหม้โดยไม่ใช้ออกซิเจน จะต้องมีการนำชีวมวลไปวิเคราะห์หาองค์ประกอบพื้นฐานทางเคมีก่อนทุกครั้ง ส่วนกระบวนการหมักและการใช้ปฏิกิริยาเคมีนั้นไม่ได้มีการวิเคราะห์ โดยองค์ประกอบพื้นฐานทางเคมีนี้สามารถแบ่งเป็น 2 ประเภทคือ
(1) องค์ประกอบพื้นฐานของธาตุต่างๆ (Elemental analysis) เช่น ร้อยละของ C, H, O และ N บางครั้งมีการหาค่าร้อยละของ S ซึ่งเป็นองค์ประกอบที่มีน้อยและก่อให้เกิดสารพิษขณะเผาไหม้
(2) องค์ประกอบทั่วไป (Proximate analysis) ที่นิยม คือ ความชื้นและปริมาณเถ้า รวมทั้งส่วนองค์ประกอบอื่นๆ ที่สามารถหาได้ เช่น สารหอมระเหยและปริมาณคาร์บอนพื้นฐาน (Fixed carbon) ดังแสดงในตารางที่ 5
ตารางที่ 5 ตัวอย่างการวิเคราะห์หาองค์ประกอบทางเคมีของชีวมวลชนิดต่างๆ (Laohalidanond, K., 2007)
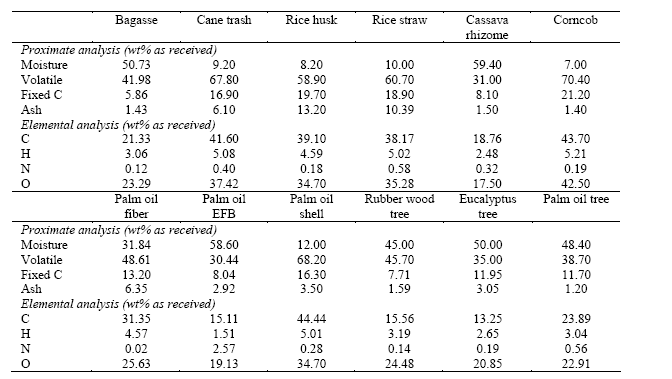
4. ลักษณะทางกายภาพของเชื้อเพลิงชีวมวล (Physical characteristic of biomass) สำหรับการนำชีวมวลมาอัดเป็นก้อนเพื่อใช้เป็นพลังงานต้องมีการวิเคราะห์ค่าความคงทนและความแข็งแรงของมวลชีวภาพก้อนซึ่งค่าดังกล่าวเรียกว่า ค่าความทนต่อแรงอัด (Compressive strength ,Ulimate
stress) เป็นค่าความแข็งแรงทนทานของก้อนชีวมวลที่สร้างขึ้น ซึ่งค่านี้หาได้จากใช้น้ำหนัก 2 กิโลนิวตัน กดลงไปด้วยอัตรา 0.5 มิลลิเมตร/นาที จนกระทั่งชีวมวลมีการแตกหรือหัก ค่าความทนต่อแรงอัดขึ้นอยู่กับวัสดุที่ใช้โดยพบว่า ชีวมวลที่มีค่าความทนต่อแรงอัดเรียงลำดับจากมากไปน้อยได้ดังนี้ คือ แกลบ ชานอ้อย ฟางข้าว และผักตบชวา จะเห็นได้ว่าแกลบมีค่าความทนต่อแรงอัดสูง เนื่องจากซิลิกาในแกลบเปลี่ยนเป็นซิลิเกตซึ่งเป็นโครงสร้างที่แข็งแรง นอกจากค่าความทนต่อแรงอัดแล้ว ยังมีค่าทางกายภาพที่สำคัญของก้อนชีวมวลคือ ค่าความเหนียว (Toughness) ซึ่งหมายถึง ความสามารถของชีวมวลในการดูดพลังงานก่อนเกิดการแตก โดยความเหนียวนี้หมายรวมถึงความแข็งแรงและความยืด (% ความยาวก่อนการแตก) (Jamradloedluk, J. and Wiriyaumpaiwong, S., 2007)
5. ปริมาณก๊าซที่ปลดปล่อยออกมา (amount of gas emission) เนื่องจากการใช้พลังงานจากชีวมวลมีเป้าหมายที่สำคัญคือ การลดปริมาณก๊าซพิษที่ปล่อยออกสู่บรรยากาศ ดังนั้นจึงต้องมีการวิเคราะห์หาปริมาณก๊าซต่างๆ ที่ปล่อยออกมา เช่น CO2, CO, NOx , O2 และซัลเฟอร์ไดออกไซด์ (SO2) ซึ่งก๊าซเหล่านี้ก่อให้เกิดผลเสียต่อสภาพแวดล้อมแตกต่างกัน ปัจจุบันในทวีปยุโรปมีการกำหนดมาตรฐานไว้เป็นระดับต่างๆ สำหรับการปลดปล่อย CO จากการเผาไหม้ชีวมวล ดังแสดงในตารางที่ 6 เนื่องจาก CO เป็นตัวชี้วัดที่สำคัญสำหรับ การเผาไหม้ที่ไม่สมบูรณ์ ส่วนการปลดปล่อย NOx นั้นไม่ได้มีกำหนดไว้เป็นมาตรฐานแต่อย่างใด แต่การปลดปล่อย NOx และก๊าซชนิดอื่นๆ ควรจะให้มีปริมาณน้อยที่สุด โดยพบว่า การใช้ชีวมวลที่เป็นผลิตภัณฑ์จากพืชจะมีค่าการปลดปล่อย NOx ที่ใกล้เคียงกัน (Malatak, J., et al., 2007)
ตารางที่ 6 ระดับการปลดปล่อยก๊าซคาร์บอนมอนอกไซด์
|
ระดับการปลดปล่อย CO
|
ปริมาณการปลดปล่อย CO (%)ที่ O2 13 %
|
|
ระดับ 1
|
≤0.3*
|
|
ระดับ 2
|
>0.3 ≤0.8*
|
|
ระดับ 3
|
>0.8 ≤1.0*
|
หมายเหตุ * 1 mg/m3 = 0.0001 %
ที่มา : Malatak, J., et al (2007)
บทสรุป
การนำชีวมวลมาใช้เพื่อผลิตพลังงานนั้น สามารถแก้ปัญหาเรื่องของราคาน้ำมันแพงได้และช่วยลดปัญหาสภาวะแวดล้อมให้กับโลก การนำชีวมวลมาเปลี่ยนเป็นพลังงานนั้นมีหลายวิธีด้วยกัน ซึ่งแต่ละวิธีนั้นมีความเหมาะสมในการนำพลังงานไปใช้ประโยชน์แตกต่างกัน โดยสามารถแบ่งได้เป็น 3 วิธีคือ 1. การให้ความร้อน เช่น การเผาไหม้โดยตรง (Combustion) การเผาไหม้โดยไม่ใช้ออกซิเจน (Pyrolysis) และการทำให้เกิดก๊าซ (Gasification) 2. การใช้กระบวนการทางชีวเคมี เช่น การหมักชีวมวลเพื่อให้เกิดเอทานอล หรือ ก๊าซมีเทน และ 3. การใช้ปฏิกิริยาเคมี เช่น การผลิตไบโอดีเซล ซึ่งการแปรรูปชีวมวลเป็นพลังงานแต่ละวิธีนั้นมีประโยชน์ที่แตกต่างกัน แต่วิธีที่น่าสนใจ คือ วิธีการต่างๆ ที่เปลี่ยนให้เชื้อเพลิงที่ได้จากชีวมวลอยู่ในรูปของของเหลว เช่นการเผาโดยไม่ใช้ออกซิเจนแบบเร็ว การหมักเพื่อผลิตเอทานอล และการผลิตไบโอดีเซล โดยเชื้อเพลิงเหลว มีข้อดี คือ สามารถขนย้ายและจัดเก็บได้สะดวกกว่าเชื้อเพลิงแข็งและก๊าซ พลังงานจากชีวมวลสามารถนำไปใช้ประโยชน์ในส่วนต่างๆได้ เช่น การนำไปใช้ในบ้านเรือน อุตสาหกรรมขนาดเล็กและอุตสาหกรรมขนาดใหญ่ การที่พลังงานจากชีวมวลมีราคาถูกกว่าพลังงานจากเชื้อเพลิงฟอสซิลนั้นถือเป็นแรงจูงใจให้กับนักลงทุนพร้อมที่จะลงทุน แต่ทั้งหมดนี้จะต้องคำนึงถึงความคุ้มค่าในเชิงพาณิชย์ รวมทั้งต้องมีการพัฒนาเทคโนโลยี การจัดการและแหล่งของชีวมวลต่างๆ โดยมีการสนับสนุนของรัฐบาลอย่างจริงจัง
อ้างอิง
สิทธิศักดิ์ อุปริวงศ์, ปิยะเมธ ทองละมุน และ สำรวย นางทะราช. การผลิตเอทธานอลจากมันสำปะหลังเพื่อพลังงานทดแทน.
2548. 11-13 พฤษภาคม; ชลบุรี : โรงแรมแอมบาสเดอร์ ซิตี้ จอมเทียน. 2548. หน้า. RE02-1- RE02-4.
Bhattacharya, SC. Pyrolysis and gasification of biomass. In Hertzmark, DI. US-ASEAN seminar on energy
technology : biomass • coal • solar/wind • energy planning. LIPI : Asean Institute of Technology, 1982, p. 95-100.
Bridgwater, AV. Thermal biomass conversion technologies for energy and energy carrier production. In Parmon, VN., et al.
Chemistry for the energy future. London : Blackwell Science, 1999, p.137-186.
Chomcharn, A. Biomass uses, conversions, and productions in Thailand. In Hertzmark, DI. US- ASEAN seminar on
energy technology : biomass • coal • solar/wind • energy planning. LIPI : Asean Institute of Technology, 1982, p. 207-222.
Choorit, W. and Wisarnwan, P. Effect of temperature on the anaerobic digestion of palm oil mill effluent. Electronic Journal of Biotechnology,
July, 2007, vol. 10, no. 3, p. 376-385.
Datar, RP., et al. Fermentation of biomass-generated producer gas to ethanol. Biotechnology and Bioengineering, June, 2004, vol. 86,
no. 5, p. 587-594.
Hall, DO., and Rosillo-Calle, F. Biological conversion of biomass to high-quality chemical carriers. In Parmon, VN., et al.
Chemistry for the energy future. London : Blackwell Science, 1999, p.121-135.
Hertzmark, D. State of the art lecture : Biomass. In Hertzmark, DI. US-ASEAN seminar on energy
technology : biomass • coal • solar/wind • energy planning. LIPI : Asean Institute of Technology, 1982, p. 62-84.
Hinrich, RA. and Kleinbach, M. Energy-its use and the environment. 3rd ed. United States : Thomson Learning, Inc., 2002, p. 540-571.
Hossain, ABMS., et al. Biodiesel fuel production from algae as renewable energy. American Journal of Biochemistry and Biotechnology,
2008, vol. 4, no. 3, p. 250-254.
Jamradloedluk, J. and Wiriyaumpaiwong, S. Production and characterization of rice husk based charcoal briquettes.
KKU Engineering Journal, July/August, 2007 vol. 34, no. 4 , p. 391-398.
Jingjing, L., et al. Biomass energy in China and its potential. Energy for Sustainable Development, December, 2001, vol. 5, no. 4, p. 66-80.
Laohalidanond, K. The production of synthetic diesel from biomass. CMU. J. Nat. Sci., 2007, vol. 6, no.1, p. 127-139.
Loehr, RC. Diffusion of biomass energy technology in developing countries. 2nd ed. Washigton, D.C. : National Academy Press, 1984, p. 36-44.
Malatak, J., et al. Heat-emission characteristic of some energy plants. J. of. Fac. of Agric., OMU, 2007, vol. 22, no. 2, p. 202-206.
Ptasinski, KJ., Prins, MJ., and Pierik, A. Exergetic evaluation of biomass gasification. Energy, 2006, vol. 32, no. 4, p. 568-574.
Yang, YB., et al. Combustion of a single particle of biomass. Energy & Fuel, 2008, vol. 22, p. 306-316.