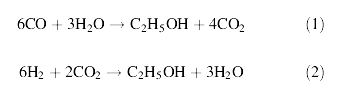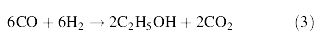เทคโนโลยีที่สำคัญในการแปรรูปชีวมวลเป็นพลังงาน
การแปรรูปชีวมวลเป็นพลังงานนั้นมีอยู่ด้วยกันหลายวิธี จำแนกได้เป็น 3 วิธีหลักคือ
1. วิธีเคมีความร้อน (Thermochemical process) เป็นการแปรรูปชีวมวลให้เป็นพลังงานโดยการใช้ความร้อนจนเกิดการเปลี่ยนแปลงทางเคมี เช่น การเผาไหม้โดยใช้ออกซิเจนหรือการสันดาป (Combustion) การเผาไหม้โดยไม่ใช้ออกซิเจนหรือไพโรลิซิส (Pyrolysis) และการทำให้เกิดก๊าซ (Gasification)
2. วิธีชีวเคมี (Biochemical process) เป็นการแปรรูปชีวมวลเป็นพลังงานโดยอาศัยปฏิกิริยาทางชีวเคมีซึ่งต้องพึ่งพาจุลชีพชนิดต่างๆ เช่น แบคทีเรียและรา โดยนำไปหมักจนเกิดการเปลี่ยนแปลงเป็นสารอินทรีย์ที่นำไปใช้เป็นพลังงานได้ในรูปของเอทานอลและก๊าซมีเทน (CH4)
3.วิธีปฏิกิริยาเคมี (Chemical process) เป็นการแปรรูปชีวมวลเป็นพลังงานโดยการใช้ปฏิกิริยาเคมี เช่น การผลิตไบโอดีเซล (Hertzmark, D., 1982) โดยลักษณะและผลิตภัณฑ์ที่ได้จากเทคโนโลยีการแปรรูปชีวมวลไปเป็นพลังงานของแต่ละวิธีมีรายละเอียดดังนี้
A. การเผาไหม้หรือการสันดาป (Combustion) (Yang, YB., et al., 2008 ; Malatak, J., et al., 2007)
การเผาไหม้หรือการสันดาป เป็นวิธีการเก่าแก่และง่ายที่สุดในการแปรรูปชีวมวลเป็นพลังงาน การเผาไหม้ส่วนใหญ่จะใช้วัตถุดิบที่เป็นไม้หรือเปลือกไม้ชนิดต่างๆ ในรูปของฟืน พลังงานที่ได้มีค่าประสิทธิภาพความร้อน (Heating value ซึ่งหมายถึง ค่าพลังงานที่ผลิตได้/ค่าพลังงานที่ให้) ประมาณ 35-40% ซึ่งถือว่าเป็นวิธีที่มีประสิทธิภาพในการแปรรูปชีวมวลเป็นพลังงานน้อยที่สุด ซึ่งต่อมาได้มีการพัฒนาวิธีในการเพิ่มประสิทธิภาพให้กับการเผาไหม้โดยการเพิ่มความดันในการเผาไหม้และการจำกัดออกซิเจนในเตาเผา
นอกจากการเผาไหม้แล้วยังมีการพัฒนาเพื่อเพิ่มประสิทธิภาพของการให้พลังงาน โดยเริ่มจากการนำ ชีวมวลชนิดต่างๆ ที่มีอยู่ในธรรมชาติ เช่น แกลบ ฟางข้าว กาบมะพร้าว ใยมะพร้าว ชานอ้อย และซังข้าวโพด รวมทั้งขี้เลื่อยมาทำให้แห้งก่อน แล้วจึงนำชีวมวลนั้นมาเผาซึ่งเป็นการให้ความร้อนโดยตรง แต่เนื่องจากชีวมวลเหล่านั้นมีความชื้นมากและมีความหนาแน่นน้อยทำให้ได้ค่าประสิทธิภาพความร้อนต่ำ จึงไม่เหมาะที่จะนำมาเผาไหม้โดยตรงและทำให้เกิดความไม่สะดวกในด้านต่างๆ เช่น การขนส่งและการจัดเก็บ ซึ่งต้องใช้พื้นที่มาก ดังนั้นจึงได้มีการนำชีวมวลมาอัดเป็นก้อนเพื่อเพิ่มความหนาแน่นและประสิทธิภาพด้านความร้อนให้สูงขึ้น โดยการนำชีวมวลไปบดแล้วอัดเป็นก้อน ผลที่ได้คือ มีประสิทธิภาพความร้อนเพิ่มขึ้น นอกจากนี้มีการพัฒนาโดยใช้ชีวมวลตั้งแต่ 2 ชนิดขึ้นไปนำมาผสมให้เข้ากันในอัตราส่วนต่างๆ แล้วใส่ตัวประสานเข้าไปเพื่อช่วยให้ชีวมวลยึดติดกันมากขึ้น เป็นการเพิ่มประสิทธิภาพความร้อนให้สูงขึ้น โดยประสิทธิภาพความร้อนที่ได้ขึ้นอยู่กับปัจจัยต่างๆ เช่น วัตถุดิบที่ใช้ ปริมาณของการผสมวัตถุดิบ ชนิดและปริมาณของตัวประสาน ขนาดของก้อนเชื้อเพลิงซึ่งการนำพลังงานที่ได้จากการเผาไหม้ไปใช้ประโยชน์มีหลายลักษณะดังนี้ (Chomcharn, A., 1982)
- สำหรับการหุงต้มอาหาร เป็นที่นิยมมากในชนบท เช่น ทำเป็นฟืน ถ่าน ไม้ และเศษเหลือทิ้งทางเกษตรกรรม
- สำหรับอุตสาหกรรมท้องถิ่น เช่น นำไปเป็นตัวให้ความร้อนในเตาเผาสำหรับการทำอิฐ เซรามิก ยาสูบ
- สำหรับอุตสาหกรรมขนาดกลาง การแปรรูปชีวมวลเป็นพลังงานโดยอาศัยการเผาไหม้ถือว่ามีประสิทธิภาพน้อยเมื่อเทียบกับวิธีอื่นที่ใช้ในปัจจุบัน กล่าวคือ ถ้าต้องการพลังงานจากการเผาไหม้มากจะต้องสิ้นเปลืองวัตถุดิบ รวมทั้งการขนส่งและพื้นที่ในการจัดเก็บมากตามไปด้วย และยังไม่สามารถจัดเก็บพลังงานที่ได้เพื่อนำไปใช้ประโยชน์หรือขนส่งพลังงานไปใช้ในที่อื่นๆ ได้ นอกจากนี้การเผาไหม้โดยตรงยังก่อให้เกิดมลภาวะต่อสิ่งแวดล้อมเนื่องจากสารเคมีในชีวมวลเหล่านั้นเมื่อได้รับความร้อนสูงขึ้นในระดับหนึ่งจะเกิดการแปรสภาพเป็นสารพิษ ก่อให้เกิดอันตรายแก่คนที่อยู่ข้างเคียง โดยเฉพาะโรคระบบทางเดินหายใจและโรคมะเร็ง นอกจากนี้ ยังไม่รวมถึงหมอกควันที่เกิดจากการเผาไหม้ที่สร้างทัศนวิสัยที่ไม่ดีให้กับผู้ที่อยู่รอบข้าง โดยมีตัวอย่างที่เกิดขึ้นในประเทศจีนที่ประสบปัญหาอยู่ในขณะนี้ (Jingjing, L., et al., 2001)
B.ไพโรลิซิส (Pyrolysis) (Bhattacharya, SC., 1982; Bridgwater, AV., 1999)
ไพโรลิซิส (Pyrolysis) หรือ การเผาโดยไม่ใช้ออกซิเจน เป็นการสลายวัตถุดิบที่มีองค์ประกอบของคาร์บอนโดยใช้อุณหภูมิสูงระหว่าง 400-800 เคลวิน โดยไม่เกิดการออกซิไดซ์ซึ่งชีวมวลที่ใช้ในกระบวนการนี้คือ พืชที่มีเซลลูโลส หรือ ไม้ยืนต้นต่างๆ เศษไม้ ฟาง ฯลฯ
วิธีในการแปรรูปชีวมวลไปเป็นพลังงานเริ่มจากการลำเลียงและการทำให้ชีวมวลแห้ง เมื่อชีวมวลแห้ง ดีแล้วจึงนำไปหั่นเป็นชิ้นเล็กๆ จากนั้นนำไปใส่ในส่วนที่ทำให้เกิดปฏิกิริยาไพโรลิซิส ผลิตภัณฑ์ที่ได้จะถูกนำไปแยกส่วนที่เป็นของแข็งและเถ้าออกจากของเหลว จากนั้นจึงนำส่วนที่เป็นของเหลวไปเก็บไว้ในถังเก็บ ซึ่งความร้อนที่ใช้ในปฏิกิริยาไพโรลิซิสเป็นความร้อนแบบทางตรงและทางอ้อม ความร้อนทางอ้อม หมายถึง การให้ความร้อนภายนอก ได้แก่ การเผาด้วยก๊าซ ส่วนความร้อนทางตรงคือ การใช้ลมร้อนจากเหล็ก ผลิตภัณฑ์ที่ได้จากปฏิกิริยาไพโรลิซิสจะเป็นของผสมระหว่างก๊าซ ของเหลวและถ่าน ซึ่งสัดส่วนของก๊าซ ของเหลวและถ่านนั้นจะขึ้นอยู่กับวิธีและรูปแบบของปฏิกิริยาไพโรลิซิส และปัจจัยต่างๆ ดังแสดงในตารางที่ 2
ตารางที่ 2 รูปแบบของปฏิกิริยาไพโรลิซิสแบบต่างๆ
|
รูปแบบของปฏิกิริยาไพโรลิซิส
|
เวลา
|
ความร้อนที่ให้
|
สภาพในการทำปฏิกิริยา
|
ความดัน
(บาร์)
|
อุณหภูมิ
(เคลวิน)
|
ผลิตภัณฑ์
|
|
การทำถ่าน
|
ชม./วัน
|
ต่ำมาก
|
สิ่งที่ได้จาก
การเผาไหม้
|
1
|
400
|
ของแข็ง
|
|
แบบเดิม
|
5-30 นาที
|
ต่ำ
|
สิ่งที่ได้จากผลิตภัณฑ์ปฐมภูมิและทุติยภูมิ
|
1
|
600
|
ก๊าซ ของเหลว ของแข็ง
|
|
แบบเร็ว
|
< 1 วินาที
|
สูง
|
สิ่งที่ได้จาก ผลิตภัณฑ์ปฐมภูมิ
|
1
|
< 600
|
ของเหลว
|
|
แบบเร็ว
|
< 1 วินาที
|
สูง
|
สิ่งที่ได้จากผลิตภัณฑ์ปฐมภูมิ
|
1
|
> 700
|
ก๊าซ
|
|
สูญญากาศ
|
2-30 วินาที
|
กลาง
|
สูญญากาศ
|
< 0.1
|
400
|
ของเหลว
|
|
ไฮโดรไพโรลิซิส
|
< 10 วินาที
|
สูง
|
ไฮโดรเจนและสิ่งที่ได้จากผลิตภัณฑ์ปฐมภูมิ
|
20
|
< 500
|
ของเหลว
|
|
เมทาโนไลซิส
|
0.5-1.5 วินาที
|
สูง
|
มีเทนและสิ่งที่ได้จากผลิตภัณฑ์ปฐมภูมิ
|
3
|
1050
|
เบนซิน
โทลูอีน
ไซลีน อีทีน
|
ที่มา : Bridgwater, AV. (1999)
เดิมปฏิกิริยาไพโรลิซิสเป็นปฏิกิริยาที่เกิดขึ้นอย่างช้าๆ และใช้อุณหภูมิต่ำเพื่อให้ได้ผลผลิตถ่านออกมามากที่สุด ต่อมามีการปรับปรุงการให้อัตราความร้อนเพิ่มขึ้นและใช้อุณหภูมิปานกลางอย่างต่อเนื่อง จนกระทั่งเกิดก๊าซ ซึ่งก๊าซนั้นจะถูกควบแน่นต่อไป และมีการสลายตัวของสารโมเลกุลใหญ่เพื่อให้ได้ปริมาณก๊าซที่มากขึ้น เชื้อเพลิงเหลวซึ่งเป็นผลิตภัณฑ์ที่ได้จากปฏิกิริยาไพโรลิซิสจะถูกนำไปวิเคราะห์ค่าต่างๆ เช่น ความหนาแน่น ความหนืด แรงตึงผิว ค่าความร้อน ผลพลอยได้จากปฏิกิริยาไพโรลิซิสที่อยู่ในรูปของก๊าซและของแข็งซึ่งเป็นสารไฮโดรคาร์บอนจำนวนมาก รวมทั้งสารโมเลกุลต่ำที่ไม่ได้ควบแน่นเป็นของเหลว การแยกเชื้อเพลิงเหลวในปฏิกิริยาไพโรลิซิสมีหลายวิธี ได้แก่ การสกัดด้วยตัวละลาย การกลั่นลำดับส่วน การชะด้วย ตัวทำละลาย ซึ่งวิธีดังกล่าวจะทำให้เชื้อเพลิงเหลวที่ได้จากปฏิกิริยาไพโรลิซิสมีสิ่งเจือปนประเภทต่างๆ ดังนี้
ก. น้ำ - ทำให้ค่าความร้อน ความหนืด ความเสถียรทางเคมีและกายภาพลดลงและการเอาน้ำออกจากเชื้อเพลิงเหลวนั้นทำได้ยาก
ข. ของแข็ง - เป็นพวกถ่านหรือเถ้า ซึ่งสามารถแยกของแข็งเหล่านี้ออกมาจากเชื้อเพลิงเหลว โดยการใช้ไอร้อนก่อนนำเชื้อเพลิงไปกลั่นตัวเป็นของเหลว
ค. ด่าง - เป็นผลมาจากเถ้าที่มีอยู่ในปฏิกิริยาซึ่งสามารถกำจัดได้โดยการกรองไอร้อนก่อนนำเชื้อเพลิงไปควบแน่นเป็นของเหลว
ง. กรด - เป็นผลมาจากสารอินทรีย์ในชีวมวลซึ่งอาจจะทำให้ถังปฏิกิริยาเกิดสนิมได้ ดังนั้น ถังปฏิกิริยาควรทำมาจากเหล็กกล้า หรือการใช้ระบบความดันเข้าช่วย
นอกจากนี้ เชื้อเพลิงเหลวที่ได้อาจมีปัญหาเกี่ยวกับคุณสมบัติในเรื่องความเสถียรเนื่องจากเชื้อเพลิงเหลวสามารถเกิดพอลิเมอร์เป็นสายยาวได้ที่อุณหภูมิมากกว่า 100 เคลวิน ซึ่งมีผลต่อความหนืดของเชื้อเพลิงเหลวที่ได้ ดังนั้นจึงควรเก็บเชื้อเพลิงเหลวที่อุณหภูมิต่ำกว่า 100 เคลวิน รวมทั้งหลีกเลี่ยงการสัมผัสกับออกซิเจน
ปฏิกิริยาไพโรลิซิสแบบเร็ว เป็นวิธีการที่ได้รับความนิยมมากที่สุด เนื่องจากเป็นการแปรรูปชีวมวล โดยอาศัยความร้อนเพื่อให้เกิดเชื้อเพลิงเหลวมากที่สุด อีกทั้งง่ายต่อการจัดการ การจัดเก็บ การขนส่งและการนำไปใช้งาน ซึ่งถือเป็นข้อได้เปรียบมากกว่าวิธี Gasification และการเผาไหม้โดยตรง ซึ่ง 2 วิธีนี้ไม่สามารถจัดเก็บหรือขนส่งได้ทันที ตลอดจนสามารถนำพลังงานที่ได้จากปฏิกิริยาไพโรลิซิสไปใช้ประโยชน์ได้อย่างกว้างขวาง อาทิ การผลิตขนาดเล็กเพื่อใช้เองในชนบท ซึ่งให้ค่าพลังงานความร้อนน้อยและการผลิตขนาดใหญ่ ซึ่งใช้วัตถุดิบเป็นไม้ มีการพัฒนาเรื่องของการเก็บและการแยกให้บริสุทธิ์ ทำให้ได้ผลิตภัณฑ์เป็นของเหลวได้แก่ เมทานอล น้ำมันดินและกรดน้ำส้ม ปัญหาที่พบได้จากปฏิกิริยาไพโรลิซิสแบบเร็วคือ การถ่ายเทความร้อนสูงให้กับวัตถุดิบ การควบคุมอุณหภูมิที่มีผลดีต่อปริมาณและคุณภาพของผลิตภัณฑ์ที่ได้และระยะเวลาในการเกิดไอควรมีค่าน้อยเพื่อให้ปฏิกิริยาไม่พึงประสงค์เกิดน้อยที่สุด ตลอดจนการควบคุมปฏิกิริยาการควบแน่นและการเก็บส่วนที่เป็นของเหลว
C. การทำให้เกิดก๊าซ (Gasification) (Chomcharn, A., 1982; Bridgwater, AV., 1999; Ptasinski, KJ., Prins, MJ., and Pierik, A., 2006)
Gasification เป็นการย่อยสลายชีวมวลโดยการให้ความร้อนกับองค์ประกอบทางเคมีของชีวมวลโดยใช้กระบวนการออกซิเดชันบางส่วน (Partial oxidation) โดยใช้ตัวออกซิไดซ์ ได้แก่ อากาศ ออกซิเจนหรือไอน้ำ จนกระทั่งเกิดผลิตภัณฑ์เป็น CO2 CO CH4 ก๊าซไฮโดรเจน (H2) ก๊าซไนโตรเจน (N2) (ในกรณีที่ใช้อากาศเป็นตัวออกซิไดซ์) และก๊าซที่มีองค์ประกอบของไฮโดรคาร์บอนเกิดขึ้นเล็กน้อย เช่น ก๊าซอีเทน ก๊าซอีทีน ตลอดจน น้ำ เขม่า เถ้า และน้ำมันดิน การให้ความร้อนกับชีวมวลโดยไม่เกิดการออกซิไดซ์จะเรียกว่า Pyrolysis แต่เมื่อนำผลิตภัณฑ์จากปฏิกิริยาไพโรลิซิสไปทำปฏิกิริยากับตัวออกซิไดซ์ (ปกติเป็นอากาศ) จะเกิดก๊าซ CO, CO2, H2 และอื่นๆ การเกิด Char gasification เป็นการรวมตัวกันของปฏิกิริยาระหว่างก๊าซและของแข็ง และปฏิกิริยาระหว่างก๊าซและก๊าซหลายๆ ปฏิกิริยารวมกันเพื่อที่จะเปลี่ยนถ่านไปเป็น CO, CO2, และ H2 โดยผ่านปฏิกิริยา Water-gas shift ซึ่งเป็นการออกซิไดซ์เพื่อเปลี่ยนจากก๊าซไปเป็นของแข็งโดยปฏิกิริยานี้เป็นปฏิกิริยาที่เกิดช้าที่สุดและเป็นตัวกำหนดอัตราการเกิดปฏิกิริยา gasification ผลิตภัณฑ์ที่ได้จากปฏิกิริยาจะเป็นก๊าซผสม โดยสัดส่วนของก๊าซแต่ละชนิด ซึ่งขึ้นอยู่กับส่วนประกอบของวัตถุดิบ ปริมาณน้ำ อุณหภูมิในการเกิดปฏิกิริยา และระยะเวลาในการออกซิไดซ์ ดังแสดงในตารางที่ 3
ตารางที่ 3 องค์ประกอบของก๊าซชนิดต่างๆ ที่ได้จากการทำให้เกิดก๊าซ (gasification) ของชีวมวลแต่ละชนิด
|
ชนิดเชื้อเพลิง
|
อุณหภูมิ(๐C)
|
ปริมาณอากาศ
กก./กก.ชีวมวล
|
องค์ประกอบของก๊าซจากgasification (เศษส่วนโมล)
|
|
H2O
|
N2
|
H2
|
CO
|
CO2
|
CH4
|
H2S
|
|
ถ่านหิน
|
832
|
2,836
|
0.005
|
0.500
|
0.158
|
0.324
|
0.009
|
0.001
|
0.003
|
|
น้ำมันพืช
|
875
|
3,837
|
0.003
|
0.467
|
0.251
|
0.275
|
0.003
|
0.001
|
0.000
|
|
ฟางข้าว
|
659
|
1,401
|
0.063
|
0.384
|
0.225
|
0.205
|
0.113
|
0.010
|
0.000
|
|
ไม้ยืนต้นมีการปรับปรุง
|
655
|
1,628
|
0.062
|
0.409
|
0.213
|
0.194
|
0.112
|
0.010
|
0.000
|
|
ไม้ยืนต้นไม่มีการปรับปรุง
|
642
|
1,452
|
0.076
|
0.380
|
0.227
|
0.177
|
0.126
|
0.013
|
0.000
|
|
ไม้ล้มลุก
|
621
|
1,240
|
0.097
|
0.363
|
0.232
|
0.146
|
0.145
|
0.018
|
0.000
|
|
น้ำทิ้ง
|
600
|
1,237
|
0.186
|
0.412
|
0.192
|
0.056
|
0.147
|
0.004
|
0.003
|
|
มูลสัตว์
|
600
|
1,247
|
0.246
|
0.395
|
0.171
|
0.018
|
0.147
|
0.002
|
0.001
|
ที่มา : Ptasinski, KJ., Prins, MJ., and Pierik, A. (2006)
การเกิดปฏิกิริยา Gasification มีด้วยกันหลายระบบโดยแยกตามการเข้า-ออกของชีวมวลและก๊าซที่เข้าไปในปฏิกิริยาดังนี้
- Updraft gasification เป็นการป้อนชีวมวลจากด้านบนลงด้านล่างของถังปฏิกิริยา (Gasifier) เพื่อให้ทำปฏิกิริยากับตัวออกซิไดซ์ทางด้านล่างเพื่อให้เกิดผลิตภัณฑ์เป็นถ่าน จากนั้นถ่านจะถูกนำไปทำปฏิกิริยาต่อไปจนเกิดเป็นก๊าซผสมระหว่างน้ำมันดินและไฮโดรคาร์บอนที่มีค่าความร้อนสูงซึ่งจะออกทางด้านบน และสุดที่เป็นเถ้าจะออกทนำไปทิ้งทางด้านล่างของ Gasifier ซึ่งก๊าซที่ได้นี้จะถูกนำไปทำให้บริสุทธิ์ต่อไป วิธีนี้เชื้อเพลิงที่ได้มีราคาถูกเหมาะกับการนำไปผลิตเป็นกระแสไฟฟ้า ต้องการพื้นที่น้อย การดำเนินการง่าย มีประสิทธิภาพสูง ก๊าซที่ได้มีอุณหภูมิต่ำและความร้อนที่ได้จากก๊าซสามารถนำไปให้ความร้อนกับวัตถุดิบได้โดยตรง
- Downdraft gasification คล้ายกับการเกิดปฏิกิริยา Updraft gasification แต่เนื่องจากการที่ให้ไอน้ำมันดินออกทางด้านบนจะไปรบกวนการเผาไหม้ภายใน ดังนั้นวิธีการนี้จึงให้ก๊าซผสมระหว่างน้ำมันดินและไฮโดรคาร์บอนซึ่งเป็นผลิตภัณฑ์ที่ได้จากปฏิกิริยานี้ออกด้านล่างโดยการให้อากาศลงด้านล่างผ่านถังหมักแล้วให้ก๊าซออกด้านล่าง เป็นการให้วัตถุดิบและก๊าซผ่านจุดที่แคบซึ่งเป็นจุดที่เกิดปฏิกิริยา ซึ่งวิธีการนี้เป็นวิธี ที่ง่ายและน่าเชื่อถือ อีกทั้งมีปริมาณเถ้าและน้ำมันน้อย สามารถนำไปใช้กับการเผาไหม้ในรถยนต์และการผลิตกระแสไฟฟ้าในปริมาณที่ไม่มากได้ (Chomcharn, A., 1982; Bridgwater, AV., 1999)
กระบวนการ Gasification มักมีสิ่งปนเปื้อนอยู่ด้วย จึงจำเป็นต้องนำก๊าซผสมที่ได้ไปทำให้บริสุทธิ์ก่อนจึงจะนำก๊าซไปใช้ประโยชน์ได้ต่อไป ซึ่งปริมาณของสิ่งปนเปื้อนนั้นขึ้นอยู่กับวิธีการ Gasification และวัตถุดิบที่ใช้ในการผลิต การทำให้ก๊าซบริสุทธิ์เป็นการป้องกันการกัดกร่อน การระเบิด และผลกระทบที่จะเกิดต่อสิ่งแวดล้อม นอกจากนี้แล้วยังมีการปนเปื้อนของน้ำมันดินซึ่งปริมาณของน้ำมันดินนั้นขึ้นอยู่กับอุณหภูมิและวัตถุดิบในกระบวนการ Gasification โดยน้ำมันดินจะมีปริมาณลดลงเมื่ออุณหภูมิในการทำปฏิกิริยาเพิ่มขึ้น และพบว่า วัตถุดิบที่เป็นไม้จะให้ปริมาณน้ำมันดินมากกว่าวัตถุดิบที่เป็นถ่านหิน ซึ่งการลดปริมาณน้ำมันดินสามารถทำได้หลายวิธีคือ ใช้ตัวเร่งปฏิกิริยา เช่น โดโลไมด์ (Dolomite) นิกเกิล (Nickel) การให้ความร้อน การถูด้วยน้ำ น้ำมัน และการตกตะกอนด้วยวิธีทางไฟฟ้าสถิตย์ นอกจากนี้ ยังมีสารปนเปื้อนอื่นๆ ออกมากับก๊าซซึ่งสามารถกำจัดได้โดยใช้วิธีที่แตกต่างกันดังนี้
- โลหะแอลคาไลด์ (alkali metal) ทำให้เกิดการกัดกร่อนของใบพัด ซึ่งสามารถกำจัดออกได้โดยใช้การถูด้วยน้ำ
- ไนโตรเจน เป็นสารที่ก่อให้เกิดก๊าซออกไซด์ของไนโตรเจน (NOx) ปล่อยสู่ชั้นบรรยากาศ ซึ่งสามารถกำจัดออกได้โดยใช้การถูด้วยน้ำ
- กำมะถัน สร้างความเสียหายแก่ใบพัด กำจัดออกได้โดยใช้ dolomite
- คลอรีน เป็นสารปนเปื้อนจากยาฆ่าแมลงที่มีอยู่ในชีวมวล กำจัดออกได้โดยการดูดในถังหรือการละลายในระบบเปียก
ก๊าซบริสุทธิ์ที่ได้ต้องมีการเติมไอน้ำลงไปในก๊าซเพื่อให้เกิดปฏิกิริยา Shift conversion ซึ่งจะเปลี่ยนจาก CO2 ไปเป็น H2 โดยปริมาณไอน้ำที่เติมลงไปขึ้นอยู่กับสัดส่วนของที่ก๊าซผสมใน Gasification จากนั้นจึงทำการแยก H2 ให้บริสุทธิ์ โดยใช้วิธีทางเคมีคือ ตัวดูดซับทางเคมีและวิธีการทางฟิสิกส์ เพื่อให้ได้ไอน้ำและ H2 ก่อนเอาน้ำออกด้วยการควบแน่น (Bridgwater, AV., 1999) กระบวนการ Gasification เมื่อใช้อากาศเป็นตัวออกซิไดซ์จะทำให้เชื้อเพลิงที่ได้มีค่าความร้อนต่ำถึงปานกลางคิดเป็น 10-15% ของพลังงานที่ได้จากก๊าซธรรมชาติ ซึ่งเหมาะสำหรับการนำไปใช้ประโยชน์ในการหุงต้มอาหาร ให้ความร้อน ใช้ในเครื่องยนต์ ใบพัด หม้อต้มน้ำ แต่ไม่เหมาะในการขนส่งทางท่อ นอกจากนี้ ก๊าซที่ได้นี้ยังสามารถนำไปเปลี่ยนเป็นน้ำมันเบนซิน เมทานอล H2 และใช้ในเซลล์เชื้อเพลิงซึ่งจะให้ค่าทางความร้อนปานกลาง วิธีการนี้ใช้กันอย่างกว้างขวางเพราะราคาถูกและ ไม่มีอันตราย ไม่ซับซ้อน กระบวนการ gasification นี้นิยมใช้กันอย่างมากในทวีปยุโรปและอเมริกาเหนือ
ปัจจุบันมีการนำ H2 และ CO ที่อุณหภูมิสูง (700-1500°C) ซึ่งเป็นก๊าซที่ได้จากกระบวนการ Gasification นำมาทำให้บริสุทธิ์และปรับสภาพให้เหมาะสม จากนั้นนำไปผลิตเป็นน้ำมันดีเซลโดยวิธี Fischer-Tropsch process ซึ่งวิธีการนี้เป็นการนำเอาก๊าซที่ได้ไปสร้างเป็นไฮโดรคาร์บอนสายยาว เช่น LPG เบนซิน ดีเซล น้ำมันเตา โดยใช้เหล็กและโคบอลต์เป็นตัวเร่งปฏิกิริยาภายใต้อุณหภูมิและความดันสูง จากนั้นนำไฮโดรคาร์บอนที่ได้ไปกลั่นเพื่อทำให้บริสุทธิ์สำหรับใช้เป็นน้ำมันเชื้อเพลิง โดยเชื้อเพลิงที่ได้มีคุณภาพดีและเป็นเชื้อเพลิงสะอาดเนื่องจากมีกำมะถันและสารประกอบอะโรเมติกส์น้อย (Laohalidanond, K., 2007)
D. กระบวนการหมัก (fermentation) (Hertzmark, D., 1982; Choorit, W. and Wisarnwan, P., 2007)
การหมัก เป็นวิธีการที่รู้จักกันมาเป็นเวลานานแล้ว ดังมีหลักฐานปรากฏในสมัยก่อนที่มนุษย์ได้นำการหมักมาใช้ประโยชน์มากมาย เช่น การหมักข้าว ผลไม้ เพื่อผลิตเบียร์และไวน์ การทำขนมปังและนม มีการพัฒนาวิธีในการหมักอย่างต่อเนื่อง โดยนำการกลั่นเข้ามาช่วยเพิ่มประสิทธิภาพในการหมัก สำหรับการหมักเพื่อผลิตพลังงานนี้ เริ่มจากนำชีวมวล เช่น มันสำปะหลัง กากของปาล์มน้ำมันและสาหร่าย มาทำการหมักโดยไม่ใช้ออกซิเจนเพื่อให้ได้สารโมเลกุลเล็ก เช่น เอทานอล และ CH
4 การหมักเป็นการย่อยสลายชีวมวลโดยไม่ใช้ออกซิเจน จัดเป็นกระบวนการทางชีวเคมีที่เปลี่ยนสารประกอบอินทรีย์ไปเป็น CH
4 และ CO
2 ปัจจัยสำคัญของการหมักคือ ความคงตัว ลักษณะของถังหมัก เวลา อัตราการป้อนวัตถุดิบ ความเป็นกรด-ด่าง (
pH) อุณหภูมิ ความเข้มข้นของผลิตภัณฑ์ ความเข้มข้นของกรดไขมัน และส่วนประกอบของวัตถุดิบ เมื่อเสร็จสิ้นการหมักแล้วยังสามารถนำชีวมวลจากการหมักไปใช้ทำปุ๋ยได้ การหมักสามารถจำแนกได้ 2 วิธีตามผลิตภัณฑ์ที่ได้คือ
1. การหมักเพื่อให้ได้เอทานอล (Hall, DO. and Rosillo – Calle, F., 1999) การหมักเอทานอลเป็นการแก้ปัญหาเรื่องน้ำมันแพงและช่วยเพิ่มมูลค่าให้กับชีวมวล เอทานอลที่ได้นี้เป็นพลังงานสะอาดและไม่ก่อให้เกิดก๊าซพิษ สามารถไปใช้ในเครื่องยนต์ได้ การหมักเพื่อให้ได้เอทานอลสามารถใช้วัตถุดิบได้หลายชนิด เช่น อ้อย มันสำปะหลัง และพืชที่มีองค์ประกอบของเซลลูโลส ซึ่งแต่ละวิธีมีรายละเอียดดังนี้
- การผลิตเอทานอลจากอ้อย หรือ ข้าวโพด ซึ่งอ้อยและข้าวโพด เป็นวัตถุดิบหลักที่ใช้ในการผลิตเอทานอลโดยการนำอ้อยหรือข้าวโพดไปหมักแบบต่อเนื่องด้วยยีสต์ จากนั้นนำไปกลั่นภายใต้ความดันต่ำ ซึ่งเอทานอล 1 ลิตรให้กระแสไฟฟ้า 0.15-0.18 กิโลวัตต์ต่อชั่วโมง (Hall, DO. and Rosillo – Calle, F., 1999)
- การผลิตเอทานอลจากพืชที่มีองค์ประกอบของเซลลูโลส จะต้องมีการย่อย 2 วิธีด้วยกัน คือการย่อยด้วยกรด (Acid hydrolysis) ซึ่งให้ประสิทธิภาพที่ดีกับไม้เนื้ออ่อนและไม้เนื้อแข็ง ในขณะที่อีกวิธีหนึ่ง คือ การย่อยด้วยเอนไซม์ (Enzymatic hydrolysis) จะให้ผลดีกับไม้เนื้อแข็งและพืชสมุนไพร การใช้เอนไซม์มีความเป็นมิตรต่อสิ่งแวดล้อมมากกว่าการใช้กรดและให้ผลผลิตสูงกว่า การหมักในโรงงานอุตสาหกรรมนิยมใช้การย่อยด้วยกรดมากกว่าการใช้เอนไซม์ และการใช้เอนไซม์จะต้องมีการบ่มก่อนจึงจะให้ผลผลิตที่สูงแต่การบ่มจะทำให้เสียค่าใช้จ่ายสูง หลังจากผ่านการย่อยแล้ว ผลิตภัณฑ์ที่ได้เป็นคาร์โบไฮเดรตซึ่งจะถูกนำไปหมักด้วยจุลินทรีย์ เช่น แบคทีเรีย ยีสต์ และราต่อไป จุลินทรีย์เหล่านี้จะทำหน้าที่เปลี่ยนคาร์โบไฮเดรตไปเป็นเอทานอลภายใต้สภาวะที่ไม่มีออกซิเจน (Hall, DO. and Rosillo – Calle, F., 1999)
- การผลิตเอทานอลจากพืชมันสำปะหลัง โดยเริ่มต้นจากการนำแป้งมันสำปะหลังไปต้มเคี่ยวด้วยเอนไซม์อะไมเลสที่อุณหภูมิ 120-150°C แล้วให้อุณหภูมิคงที่ที่ 95°C เพื่อลดเชื้อแบคทีเรียในน้ำแป้งต้มสุกนั้นเรียกกระบวนการนี้ว่า Liquefaction จากนั้นนำไปผ่านกระบวนการ Saccharification ซึ่งเป็นการนำแป้งต้มสุกที่เย็นตัวแล้ว นำไปย่อยด้วยเอนไซม์กลูโคอะไมเลสเพื่อย่อยแป้งให้กลายเป็นน้ำตาลก่อนนำไปหมัก การหมักจะใช้ Saccaromycese cerevisiae บ่มเป็นเวลา 48 ชั่วโมงที่ pH 4-5 แล้วนำไปกลั่นจนได้เอทานอล 95% นอกจากการกลั่นแล้ว ยังมีวิธีในการทำให้เอทานอลบริสุทธิ์ได้หลายวิธี เช่น การใช้เมมเบรน หรือ ตัวดูดซับ และการสกัดด้วยตัวทำละลาย (สิทธิศักดิ์ อุปริวงศ์, ปิยะเมธ ทองละมุน และสำรวย นางทะราช, 2548)
- การผลิตเอทานอลจากการหมักก๊าซ โดยใช้เชื้อแบคทีเรียในกลุ่ม Clostridium โดยก๊าซที่นำมาหมักนี้ได้ผ่านกระบวนการ Gasification ประกอบด้วยก๊าซ CO, CO2 ,CH4 , H2 , N2 ซึ่งก๊าซเหล่านี้จะถูกเปลี่ยนไปเป็นเอทานอลโดยวิธีการหมัก การหมักมีความเกี่ยวข้องกับปฏิกิริยาชีวเคมีภายในเซลล์ที่เรียกว่า Acetyl-CoA pathway ดังสมการต่อไปนี้
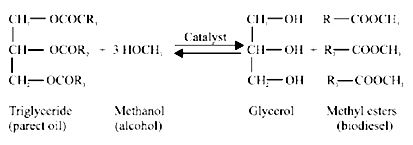
จากสมการที่ (1) และ (2) พบว่า เมื่อมี CO ซึ่งเกิดจากกระบวนการ gasification เพียงอย่างเดียว จำนวนคาร์บอนที่จะเปลี่ยนไปเป็นเอทานอลมีเพียง 1 ใน 3 เท่านั้น โดยใช้เอนไซม์ carbonmoxoxide dehydrogenase กับ CO2 ส่วนปฏิกิริยาระหว่าง H2 กับ CO2 นั้น พบว่า คาร์บอนทุกตัวสามารถเปลี่ยนไปเป็นเอทานอลได้ทั้งหมดและเมื่อนำสมการที่ (1) และ (2) มารวมกันจะได้เป็นสมการที่ (3) ดังนี้
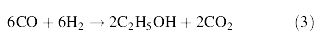
จากสมการที่ (3) พบว่า มีคาร์บอนจำนวน 2 ใน 3 ถูกเปลี่ยนไปเป็นเอทานอลโดย 2 สมการหลังนี้จะเกิดขึ้นจากการใช้เอนไซม์ Hydrogenase ดังนั้นปริมาณเอทานอลที่ได้จะขึ้นอยู่กับสัดส่วนขององค์ประกอบของก๊าซที่นำมาหมัก อีกทั้งปริมาณ H2 มีค่าน้อยกว่าที่คาดไว้เนื่องจากมีบางส่วนทำปฏิกิริยากับชีวมวลที่เป็นคาร์บอนเพื่อเปลี่ยนเป็นเอทานอล (Datar, RP., et al., 2004)
2. การหมักเพื่อให้ได้ก๊าซมีเทน การหมักเพื่อให้ได้ CH4 นั้นสามารถนำชีวมวลต่างๆ มาหมักได้ เช่น มูลสัตว์และขยะสด ในที่นี้จะขอยกตัวอย่างการผลิต CH4 จากการหมักเศษเหลือทิ้งจากปาล์มน้ำมัน ซึ่งน้ำมันที่มีอยู่ในปาล์มนั้นจะถูกเปลี่ยนไปเป็นกรดไขมันโดยจุลินทรีย์ จากนั้นกรดไขมันจะถูกเปลี่ยนไปเป็น CH4 เศษเหลือทิ้งที่มีองค์ประกอบเป็นกรดไขมันสายยาว เช่น Palmitic oleate จะเป็นตัวยับยั้งการเจริญเติบโตของเชื้อแบคทีเรีย และการเกิดก๊าซมีเทน การลดค่า COD จะทำให้เกิดไบโอก๊าซและ CH4 ซึ่งจะทำให้ต้นทุนการหมักแบบไม่ใช้ออกซิเจนลดลง (Choorit, W. and Wisarnwan, P., 2007)
E. การผลิตไบโอดีเซล (Hossain, ABMS., et al., 2008)
สาหร่ายสามารถใช้เป็นวัตถุดิบในการผลิตไบโอดีเซลได้เนื่องจากมีประสิทธิภาพในการให้ผลผลิตที่สูงกว่าชีวมวลชนิดอื่น โดยให้ผลผลิตสูงกว่าน้ำมันถั่วเหลืองถึง 250 เท่าและผลผลิตสูงกว่าปาล์ม 7-31 เท่า อีกทั้งการแยกน้ำมันให้บริสุทธิ์สามารถทำได้ง่าย โดยการนำสาหร่ายมาผลิตเป็นเชื้อเพลิงมีขั้นตอนดังนี้
1. เก็บตัวอย่างสาหร่ายสายพันธุ์ Oedogonium และ Spirogyra sp. จำนวน 26.5 กรัม และ 20.0 กรัม ตามลำดับ
2. นำสาหร่ายมาบด แล้วทำให้แห้งที่อุณหภูมิ 80 °C เป็นเวลา 20 นาที
3. ใช้ตัวทำละลายผสมของเฮกเซนและอีเทอร์เป็นตัวสกัดน้ำมัน โดยตั้งทิ้งไว้ 24 ชั่วโมง
4. กรองเพื่อแยกส่วนที่เป็นสาหร่ายออกไป
5. แยกชั้นของตัวทำละลายและทำการระเหยให้แห้ง
6. ใส่โซเดียมไฮดรอกไซด์ 0.25 กรัมผสมลงไปในเมทานอล 24 มิลลิลิตร คนให้เข้ากันเป็นเวลา 20 นาที
7. นำตัวทำละลายผสมในข้อ 5 เติมลงในสิ่งสกัดจากสาหร่าย นำไปเขย่าเป็นเวลา 16 ชั่วโมง เพื่อให้เกิดปฏิกิริยา Transesterification ดังสมการที่แสดงข้างล่างนี้
8. นำไปโอดีเซลที่ได้ไปล้างด้วยน้ำ 5% จนกว่าจะสะอาด แล้วนำไปทำให้แห้ง 12 ชั่วโมง